Цервикальные интраэпителиальные неоплазии (ЦИН) относятся к предраковым заболеваниям шейки матки. В структуре патологии шейки матки у женщин репродуктивного возраста ЦИН составляют 17–29%.
Причина этому – инфицирование вирусом папилломы человека (ВПЧ) [1]. Мишенью онкогенных типов ВПЧ является зона трансформации шейки матки, где и развиваются предраковые изменения и инвазивный рак шейки матки [2–4]. На сегодняшний день установлено, что ВПЧ – ведущий, но не единственный фактором риска развития предрака и рака шейки матки (РШМ). В настоящее время в генезе возникновения опухолей широко исследуется нарушение функции митохондриального аппарата клетки. Метаболизм опухолевых клеток имеет определенные особенности, дающие им преимущества по сравнению с нормальными клетками. Известно, что при опухолевой трансформации повышается скорость как аэробного, так и анаэробного гликолиза – процессов, происходящих с участием митохондрий [5]. Превалирование анаэробного гликолиза в опухолевых клетках объясняется быстрым ростом опухоли при недостатке кровеносных сосудов. Чем выше скорость опухолевого роста, тем интенсивнее протекает в ней анаэробный гликолиз и слабее окислительное фосфорилирование. Малигнизация клеток также происходит в связи с нарушением последовательности реакций каскада запрограммированной клеточной гибели, в реализации которого важнейшую роль играют митохондрии [6].
Сигнальный путь, в котором происходит высвобождение апоптотических факторов из митохондрий с последующей активацией цитозольных каспаз, называют митохондриальным. Отсутствие возможности перейти к апоптозу ведет к бесконтрольной пролиферации и злокачественному перерождению клетки. В связи с этим поиск новых прогностических маркеров, ассоциированных с митохондриями, является актуальной задачей, которая в дальнейшем может играть значимую роль в ранней диагностике и прогнозировании течения заболеваний шейки матки.
Цель данной работы – повысить эффективность диагностики и разработать тактику ведения пациенток с цервикальными интраэпителиальными неоплазиями на основании изучения маркеров прогнозирования, таких как белок наружной митохондриальной мембраны потенциал-зависимый анионный канал 1 (VDAC1) и белок гексокиназа 2 (HK2).
 Белок VDAC1 локализуется на внешней митохондриальной мембране и играет ключевую роль в энергетическом обмене клетки. Он обеспечивает транспорт через мембрану молекул АТФ, АДФ, пирувата, малата и других метаболитов. Кроме того, VDAC1 обеспечивает проницаемость митохондриальной мембраны для небольших белков, отвечающих за реализацию апоптотической гибели клетки. Известно, что при опухолевой трансформации происходит закрытие транзитной поры и ослабление апоптоза и, как следствие, активация клеточной пролиферации [7].
Белок VDAC1 локализуется на внешней митохондриальной мембране и играет ключевую роль в энергетическом обмене клетки. Он обеспечивает транспорт через мембрану молекул АТФ, АДФ, пирувата, малата и других метаболитов. Кроме того, VDAC1 обеспечивает проницаемость митохондриальной мембраны для небольших белков, отвечающих за реализацию апоптотической гибели клетки. Известно, что при опухолевой трансформации происходит закрытие транзитной поры и ослабление апоптоза и, как следствие, активация клеточной пролиферации [7].
Гексокиназа (АТФ-зависимая D-гексоза-6-фосфотрансфераза, КФ 2.7.1.1) является одним из ключевых ферментов гликолиза, обеспечивающим первичное фосфорилирование глюкозы. В норме энергообеспечение клетки осуществляется благодаря окислительному фосфорилированию, происходящему в митохондриях. Однако при злокачественной трансформации гликолиз становится превалирующим процессом в клеточном катаболизме, в то время как окислительное фосфорилирование сведено к минимуму. Это позволяет опухоли выживать в условиях гипоксии. Исследования показывают, что в опухолевых клетках повышается уровень связанной с белком VDAC1 гексокиназы (изозим 2, НК2), что вызывает супрессию апоптоза [8]. В связи с этим в данном исследовании нам было интересно проанализировать уровни относительной экспрессии белков VDAC1 и HK2 при низкой и высокой степени тяжести ЦИН.
Материал и методы исследования
В исследование были включены 32 женщины раннего репродуктивного возраста от 20 до 30 лет (средний возраст составил 27±3 года), обратившихся в научно-поликлиническое отделение ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. Всем пациенткам перед включением в исследование проводилось клинико-анамнестическое обследование, количественное определение условно-патогенной, патогенной и нормальной микрофлоры методом ПЦР в реальном времени (фемофлор 16, ПЦР на патогены – 7 показателей, и количественное определение вируса папилломы человека на 21 тип). Для жидкостной цитологии материал забирали из цервикального канала, переходной зоны и эндоцервикса с помощью одноразовой щеточки. Оценку результатов жидкостной цитологии производили согласно классификации Бетесда [9].
Осмотр шейки матки выполнялся при помощи зеркал и расширенной кольпоскопии. Расширенную кольпоскопию проводили по общепринятой методике, интерпретация кольпоскопической картины осуществлялась по Международной классификации кольпоскопических терминов Рио-де-Жанейро (2011) [10].
Обследованные пациентки по результатам цитологического исследования были разделены на 4 группы: контрольная группа – 10, пациентки с ASCUS (атипические клетки плоского эпителия неопределенного значения) – 9; с LSIL (плоскоклеточные интраэпителиальные поражения низкой степени) – 8; с HSIL (плоскоклеточные интраэпителиальные поражения высокой степени) – 5 пациенток.
Всем пациенткам проводилось определение уровня экспрессии белков VDAC1 и HK2 в соскобе эпителия шейки матки методом вестерн-блот анализа с детекцией хемилюминисценции по следующему протоколу. Цервикальный соскоб на щетке помещался в пробирку с 0,3 мл фосфатно-солевого буфера, дополненного смесью протеазных ингибиторов (Roсhe, ФРГ), препятствующих деградации белков. В пробирку добавляли лизирующий буфер и буфер для нанесения образцов. Разделение белков проводилось методом электрофореза в 10% полиакриламидном геле с дальнейшим переносом белков на нитроцеллюлозную мембрану (Millipore, США) в соответствии с протоколом производителя. Для блокировки сайтов неспецифического связывания антител проводили инкубацию мембраны в 5% обезжиренном молоке, приготовленном на основе трис-солевого буфера, в течение 1 часа при комнатной температуре. Окрашивание белок-специфичными и антивидовыми антителами проводили в тех же условиях. Проявка мембраны осуществлялась набором Novex ECL (Invitrogen, США) в автоматизированном приборе ChemiDoc (Biorad, США). Анализ интенсивности флуоресценции проводился в программном обеспечении ImageLab. и обсчитывался в программах.
Статистическая обработка данных была проведена в программах MS Excel и Statistica 6.0, для оценки достоверности полученных различий использовали критерий Стьюдента.
 Результаты исследования
Результаты исследования
Предварительные результаты исследования показали, что у 23 (71,8%) женщин выявлено наличие ВПЧ. Наиболее часто встречающимся типами ВПЧ были: 16 (22%) и 56 (15,6%), 18, 52, 53 и 44 (9%), 51, 31, 39, 59 и 73 (6%), а 6, 33, 58 и 66-й типы выявлены менее чем у 5% женщин. Более чем один тип ВПЧ выявлен у 10 (31,2 %) женщин. Результаты типирования ВПЧ представлены на диаграмме (рис. 1 см. на вклейке).
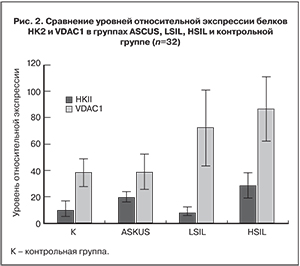
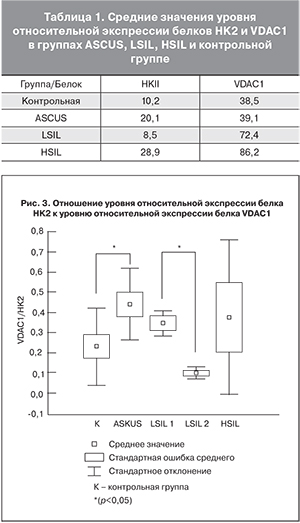
Результаты вестерн-блот анализа показали, что уровень относительной экспрессии белка VDAC1 в группе пациенток с HSIL достоверно выше по сравнению с контролем. В случае белка HK2 в данной группе наблюдается тенденция к увеличению этого показателя. Среднее значение относительной экспрессии белка VDAC1 в группе с диагнозом LSIL выше, чем в контрольной группе, однако различия статистически не значимы (табл. 1). Полученные данные позволяют предположить, что уровень экспрессии белка митохондриальной мембраны VDAC1 и белка HK2 увеличивается и коррелирует с тяжестью прогрессии ЦИН. Также имеется тенденция к увеличению уровня относительной экспрессии белка HK2 в группе пациенток с диагнозом ASCUS по сравнению с контрольной группой, что может свидетельствовать об особой природе этих малоизученных атипических клеток плоского эпителия (рис. 2).
Чтобы оценить, как согласуется относительная экспрессия обоих изучаемых белков с общей клинической картиной, было рассчитано отношение уровня экспрессии белка HK2 к уровню экспрессии митохондриального белка VDAC1. Из рис. 3. видно, что группа женщин с диагнозом L-SIL разделилась на две подгруппы: LSIL1 и LSIL2. Примечательно, что различия между данными подгруппами статистически значимы. При этом среднее значение для LSIL1 лежит выше значения контрольной группы, а для LSIL2 – ниже.
Также было показано, что определяемый показатель значимо выше в группе пациенток с диагнозом ASCUS по сравнению с контрольной группой, что требует в дальнейшем подробного изучения.
На основании полученных данных можно предположить, что группа пациенток с высоким уровнем экспрессии белка VDAC1 относится к группе с высоким риском прогрессии ЦИН, им должно быть назначено физиохимическое лечение. Пациентки группы LSIL2, вероятно, имеют низкий риск прогрессии ЦИН, и лечение может быть ограничено консервативными методами.
Обсуждение результатов
Белок наружной митохондриальной мембраны VDAC1 играет важнейшую роль в регуляции клеточной пролиферации и апоптоза [11]. Являясь одним из основных транспортных белков в мембране митохондрии, он осуществляет перенос в цитоплазму метаболитов гликолиза и продуктов окислительного фосфорилирования. Транспорт АТФ и АДФ происходит при взаимодействии белка VDAC1 и белка ANT – транслокатора адениновых нуклеотидов, который локализуется на внутренней митохондриальной мембране. При взаимодействии данные белки формируют транспортную систему, позволяющую нуклеотидам пересекать мембрану по типу антипорта: АТФ переходит в цитозоль, а АДФ в митохондриальный матрикс [12].
В 1979 г. Felgner и соавт. показали, что белок VDAC1 способен связывать гескокиназу 2 [13]. HK2 – это фермент гликолиза, осуществляющий реакцию трансфосфорилирования между АТФ и глюкозой, тем самым активируя гексозу для дальнейшего включения в гликолиз. Известно, что данный фермент чувствителен к изменению физиологических условий в клетке. При ряде заболеваний, включая злокачественную трансформацию, происходит увеличение его экспрессии, а также повышается количество HK2, связанной с белком VDAC1.
Данные нашего исследования показали, что в соскобах цервикального канала в группе пациенток с HSIL значимо повышена экспрессия белка VDAC1, а также наблюдается тенденция к увеличению биосинтеза фермента HK2. Поскольку плоскоклеточные интраэпителиальные поражения высокой степени являются истинным предраковым состоянием, то полученные результаты можно объяснить вероятным злокачественным перерождением эпителия. Бесконтрольная пролиферация клеток при недостатке кислорода активирует гликолитический путь. Для активного деления и молекулярного обмена необходимо увеличение проницаемости митохондриальной мембраны для АТФ, АДФ и прочих метаболитов, что может являться причиной повышенной экспрессии белков VDAC1 и HK2. По полученным результатам можно предположить, что уровень экспрессии белков VDAC1 и HK2 коррелирует с тяжестью прогрессии ЦИН, что в дальнейшем может стать ключом к пониманию молекулярных механизмов, происходящих в клетках с интраэпителиальными поражениями.
Эксперименты Sun и соавт. показывают, что взаимодействие HK2 с VDAC1 на поверхности митохондрий приводят к антиапоптотическому эффекту [14, 15].
Таким образом, с одной стороны, увеличение экспрессии HK2 может отражать усиление гликолиза, с другой стороны, показывает снижение уровня запрограммированной клеточной гибели.
При анализе отношения уровня экспрессии HK2 к VDAC1 группа с выявленным LSIL была разделена на 2 подгруппы: LSIL1 и LSIL2, достоверно отличающиеся. Полученные результаты совпадают с общей клинической картиной: 50% пациенток должна быть активно пролечена (LSIL1), а 50% нуждается в консервативном лечении, так как, вероятно, относится к группе с низким риском прогрессии ЦИН (LSIL2).
Отношения уровня экспрессии HK2 к VDAC1 по результатам экспериментов оказалось достоверно выше в группе пациенток с диагнозом ASCUS относительно контрольной группы. Следует отметить, что в литературе редко встречаются подробные исследования протеома и молекулярной патофизиологии данных атипических клеток плоского эпителия. Возможно, следует уделить особое внимание пациенткам с данным заболеванием, находящимся под наблюдением.
Заключение
Исходя из полученных результатов, можно сделать заключение о наличии взаимосвязи между уровнями экспрессии белка наружной митохондриальной мембраны VDAC1, фермента гексокиназы 2 и степенью тяжести цервикальной интраэпителиальной неоплазии. Эти данные свидетельствуют о том, что белки могут являться потенциальными маркерами прогнозирования прогрессии ЦИН и РШМ на ранних стадиях, что требует дальнейшего исследования.



