Заболевания щитовидной железы (ЩЖ) являются наиболее распространенной эндокринной патологией и встречаются в 5–10 раз чаще у женщин репродуктивного возраста, чем у мужчин [1].
Гипотиреоз возникает вследствие дефицита гормонов ЩЖ. В зависимости от патогенеза гипотиреоз может быть первичным (в связи с патологией самой ЩЖ) или вторичным (вследствие дефицита тиреотропного гормона (ТТГ)). Первичный гипотиреоз является одним из наиболее распространенных эндокринных заболеваний. По данным крупного популяционного исследования NHANES-III, распространенность первичного гипотиреоза составила 4,6% (0,3% – явный, 4,3% – субклинический). Вторичный гипотиреоз – более редкая форма, составляющая менее 1% случаев в структуре заболеваний ЩЖ. Распространенность данной патологии в общей популяции составляет 1:16 000–1:20 000 [2]. Причиной дефицита тиреоидных гормонов является недостаточная секреция ТТГ при отсутствии патологических изменений в ЩЖ. Причинами вторичного гипотиреоза могут быть функциональные или анатомические нарушения гипоталамо-гипофизарной системы (аденомы гипофиза, гормонально-неактивные опухоли, вызывающие компрессионные поражения, аневризмы, ятрогенные поражения после хирургических или лучевых методов лечения, травмы и т.д.) [3, 4].
По степени тяжести гипотиреоз классифицируется на явный (манифестный), сопровождающийся повышением уровня ТТГ >10 мМЕ/мл при одновременном снижении содержания свободного Т4 (свТ4) ниже референсного интервала, и субклинический, характеризующийся повышением уровня ТТГ при содержании свТ4 в пределах целевого диапазона.
Среди женщин репродуктивного возраста общая распространенность явного гипотиреоза в популяции составляет 0,2–2%, субклинического – примерно 5–10%, носительства антител без нарушения функции железы – 8–14% [5, 6]. Субклинический гипотиреоз во время беременности определяется как превышение допустимых значений ТТГ при нормальном уровне гормонов ЩЖ.
Наиболее частой причиной развития первичного гипотиреоза является аутоиммунный тиреоидит (тиреоидит Хашимото, лимфоцитарный тиреоидит, АИТ) – хроническое воспалительное заболевание ЩЖ аутоиммунного генеза, при котором в результате прогрессирующей лимфоидной инфильтрации происходит постепенная деструкция паренхимы ЩЖ с возможным исходом в первичный гипотиреоз [4].
Распространенность АИТ оценить достаточно сложно, поскольку в эутиреоидной фазе процесс не имеет точных диагностических критериев [2]. В России заболеваемость АИТ достигает 45 случаев на 1000 населения. Повсеместно АИТ является самым частым эндокринным заболеванием среди женщин и поражает примерно 5–15% женщин репродуктивного возраста [1]. В 95% случаев в крови пациентов диагностируются аутоантитела к тиреоидной пероксидазе (АТ-ТПО), тиреоглобулину и другим коллоидным и цитозольным аутоантигенам [2].
ГИПОТИРЕОЗ И БЕРЕМЕННОСТЬ
Роль материнских тиреоидных гормонов (ТГ) чрезвычайно важна во внутриутробном периоде.
ТГ являются основополагающими регуляторами формирования и созревания головного мозга плода на этапе внутриутробного развития, влияют на закладку структур мозга плода и формирование центральной нервной системы (ЦНС). Закладка ЩЖ и ЦНС плода происходит к 3–4-й неделе внутриутробного развития, но формирование ЩЖ и способность накапливать йод осуществляются к концу 12-й недели беременности. К 15–16-й неделе гестации наблюдается созревание нейроэндокринной системы плода.
Известно, что во время беременности потребность в ТГ возрастает на 30–50%. Существует ряд факторов, которые могут приводить к гиперстимуляции ЩЖ. Во-первых, наиболее мощным стимулятором ЩЖ является хорионический гонадотропин (ХГЧ), сходный по своей структуре с ТТГ. Увеличение продукции ТГ по механизму отрицательной обратной связи обусловливает подавление продукции ТТГ. Далее, по мере увеличения срока беременности, происходит снижение количества ХГЧ, и уровень ТТГ возвращается к нормальным значениям, в то время как уровень ТГ остается повышенным до конца беременности и снижается непосредственно перед родами. Во-вторых, высокие уровни эстрогенов повышают образование тироксинсвязывающего глобулина в печени, что способствует снижению свободных фракций тиронинов и приводит к повышению уровня ТТГ. В-третьих, важным является содержание йода в крови беременной как основного субстрата для синтеза ТГ. Усугубление йододефицитного состояния во время беременности происходит за счет увеличения объема почечного кровотока и гломерулярной фильтрации, что приводит к повышению почечного клиренса йода с мочой. Кроме того, йод, поступающий в организм матери, используется для синтеза гормонов ЩЖ у плода, необходимых ему для формирования ЦНС и скелета. Во второй половине беременности, в связи с формированием фетоплацентарного комплекса, происходит изменение метаболизма ТГ. Функционирование фетоплацентарного комплекса приводит к отвлечению на себя части гормонов ЩЖ и йода. В плаценте функционируют дейодиназы – ферменты, которые превращают активные ТГ в биологически неактивные метаболиты. Наибольшей активностью обладает 5-дейодиназа 3-го типа (D3), катализирующая дейодирование Т4 матери до реверсивного Т3 (рТ3), и трансформацию Т3 в дийодтирозин (Т2). Высвобождающийся в этой реакции йод может переноситься к плоду и использоваться для синтеза гормонов ЩЖ. Следовательно, активное дейодирование ТГ матери и дополнительная потеря йода служат косвенными стимуляторами гормонпродуцирующей функции ЩЖ [8, 9].
РИСКИ ОСЛОЖНЕНИЙ ТЕЧЕНИЯ БЕРЕМЕННОСТИ ПРИ СУБКЛИНИЧЕСКОМ ГИПОТИРЕОЗЕ
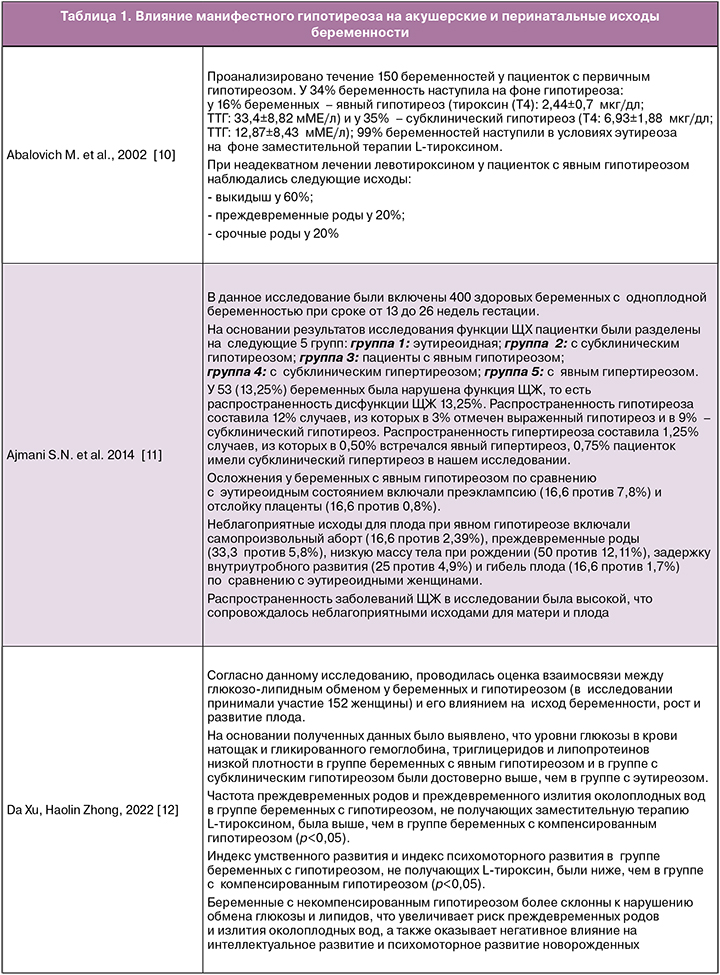
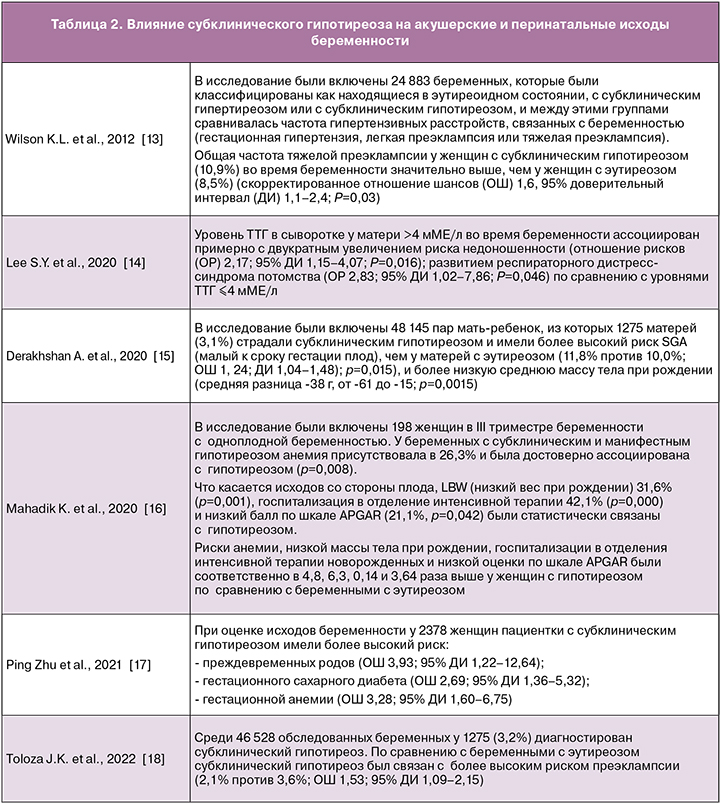
Гипотиреоз во время беременности ассоциирован с риском развития ранних и поздних осложнений гестации, таких как выкидыш, преждевременные роды, анемия, преждевременная отслойка плаценты и послеродовое кровотечение. Эти осложнения чаще встречаются при манифестном гипотиреозе, чем при субклиническом (табл. 1). Однако многочисленные данные также подтверждают неблагоприятное влияние субклинического гипотиреоза на исходы беременности. На основании анализа публикаций, посвященных влиянию субклинического гипотиреоза на акушерские и перинатальные исходы, показано, что он связан с повышенным риском невынашивания беременности – самопроизвольных абортов и преждевременных родов (табл. 2). Признаки аутоимунного процесса в ЩЖ выявляются у 2–17% беременных, причем как на основании изолированного повышения уровня антител, так и совместно с изменением тиреоидного статуса.
ОСОБЕННОСТИ ПРЕГРАВИДАРНОЙ ПОДГОТОВКИ У ПАЦИЕНТОК С ГИПОТИРЕОЗОМ
Вышесказанное обуславливает необходимость проведения обязательной прегравидарной подготовки у пациенток с гипотиреозом, планирующих беременность. У женщин, страдающих бесплодием или планирующих беременность и имеющих родственников с заболеваниями ЩЖ, необходимо определять уровень ТГ на этапе прегравидарной подготовки.
Нарушения функции ЩЖ, особенно манифестный и субклинический гипотиреоз, могут быть ассоциированы с нарушением менструального цикла и снижением фертильности.
Стоит отметить, что в настоящее время имеются некоторые особенности планирования беременности в естественном цикле и циклах ВРТ.
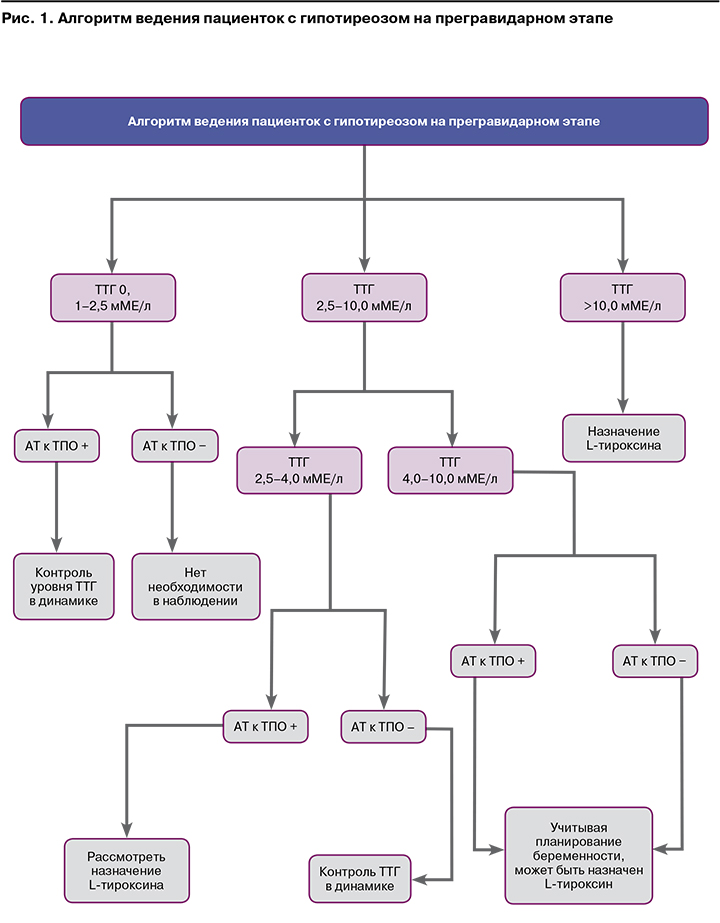
В связи с тем что уровень ТТГ может модифицироваться в зависимости от обеспечения региона проживания йодом, этнической принадлежности женщины и срока беременности, Европейская и Американская тиреоидологические ассоциации рекомендуют определение в каждом триместре специфичных референсных значений ТТГ для каждой популяции [19, 20]. При отсутствии специфических референсных значений Европейская тиреоидологическая ассоциация предлагает верхнюю границу нормы для ТТГ 2,5 мМЕ/л в I триместре, 3,0 мМЕ/л – во II триместре и 3,5 мМЕ/л – в III триместре [21]. Данные рекомендации использовались и в Российской Федерации. В 2021 г. Российским обществом эндокринологов утверждены клинические рекомендации «Гипотиреоз», в которых представлен алгоритм диагностики и лечения гипотиреоза на этапе планирования и во время беременности [2].
На прегравидарном этапе у пациенток, планирующих беременность в естественном цикле, рекомендуется исследовать функцию ЩЖ (определение уровня ТТГ в крови и уровня свТ4). При впервые выявленном повышении уровня ТТГ и нормальном уровне свТ4 рекомендуется провести повторное исследование уровней ТТГ, свТ4 через 2–3 месяца, а также определение содержания АТ-ТПО. При выявлении у женщин, планирующих беременность, антител к ткани ЩЖ и/или ультразвуковых признаков АИТ на этапе планирования и во время беременности проводится оценка функционального состояния железы в каждом триместре [2].
Как известно, почти в 90% случаев причиной первичного гипотиреоза является АИТ. Основанием для постановки данного диагноза, согласно данным национальных клинических рекомендаций 2021 г., являются диагностические признаки, или «большие критерии», сочетание которых позволяет установить АИТ как причину гипотиреоза: первичный гипотиреоз (явный или стойкий субклинический); наличие антител к ткани ЩЖ; ультразвуковые признаки аутоиммунной патологии. Важно отметить, что при отсутствии хотя бы одного из перечисленных критериев диагноз АИТ носит вероятностный характер. Также не рекомендуется определение содержания антител к ткани ЩЖ в крови в динамике с целью оценки развития и прогрессирования АИТ [2]. При диагностировании гипотиреоза единственным методом лечения является заместительная терапия препаратами ТГ (L-тироксином). Вне беременности обычная заместительная доза препарата составляет 1,6–1,8 мкг/кг, что эквивалентно 50–100 мкг/сут. Следует учитывать, что при беременности потребность в L-тироксине повышается, и его доза должна быть увеличена. Важно отметить, что о необходимости коррекции дозы женщина должна быть осведомлена заранее. На основании вышепредставленных нормативных документов и клинического опыта мы разработали алгоритм ведения пациентов с гипотиреозом на прегравидарном этапе (рис. 1).
На этапе планирования беременности также необходимо рекомендовать прием физиологической дозы калия йодида, равной 150 мкг, которая является основным компонентом для синтеза ТГ. При беременности возможно рекомендовать прием 150 мкг йода в составе комплекса поливитаминов и дополнительно необходимо назначать препараты калия йодида 50–100 мкг/сут (норма потребления йода при беременности составляет 200–250 мкг/сут).
АЛГОРИТМ ВЕДЕНИЯ ПАЦИЕНТОК С ГИПОТИРЕОЗОМ, ВСТУПАЮЩИХ В ПРОТОКОЛ ЭКО, НА ПРЕГРАВИДАРНОМ ЭТАПЕ
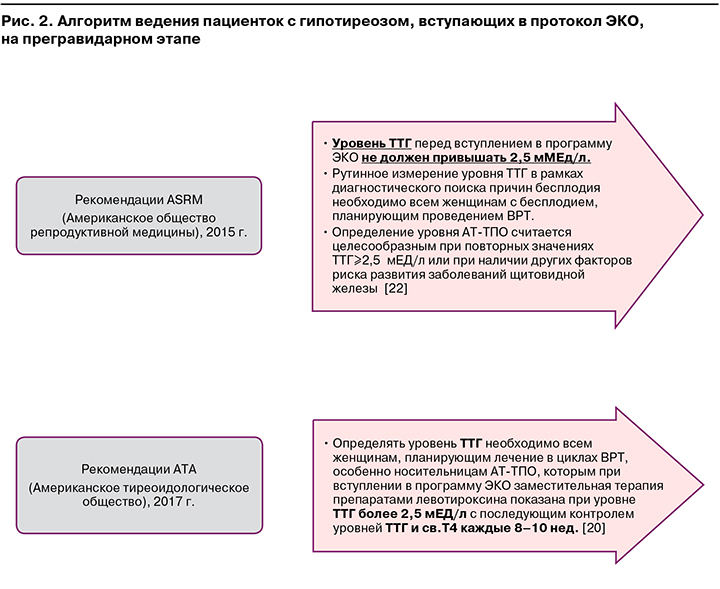
Существуют некоторые особенности ведения пациенток, планирующих лечение в рамках программы экстракорпорального оплодотворения (ЭКО). Как известно, для стимуляции суперовуляции при проведении программ ВРТ используются препараты, содержащие значительные дозы эстрогенов, биоидентичных натуральным, прием которых, в свою очередь, за счет повышения синтеза тироксинсвязывающего глобулина в печени, связывания дополнительного количества свободных ТГ и, как следствие, снижения содержания последних приводит к повышению уровня ТТГ. На основании данного механизма в 2015 г. American Society for Reproductive Medicine (ASRM) (Американское общество репродуктивной медицины) разработало клинические рекомендации, согласно которым уровень ТТГ перед вступлением в программу ЭКО не должен превышать 2,5 мЕд/л [20, 22] (рис. 2).
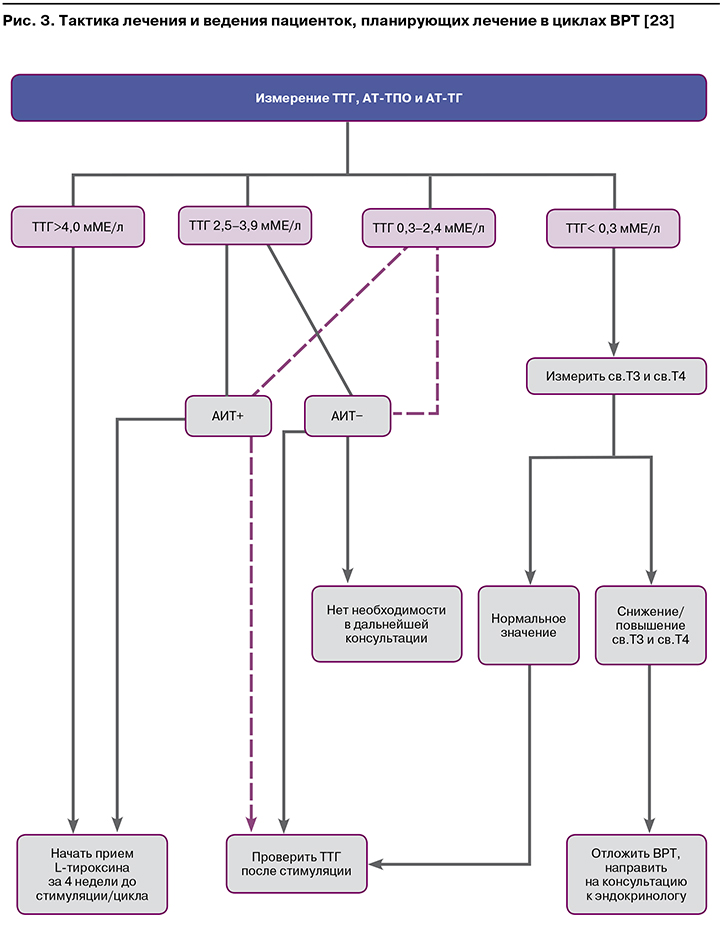
В 2018 г. Рорре K. et al. определили алгоритм обследования и ведения женщин в рамках подготовки к ЭКО/ИКСИ, который приведен на рисунке 3. Авторы считают, что им еще предстоит узнать, эффективна ли данная стратегия в улучшении показателей исходов беременностей после циклов ВРТ [23].
ОСОБЕННОСТИ ВЕДЕНИЯ ЖЕНЩИН С ГИПОТИРЕОЗОМ ВО ВРЕМЯ БЕРЕМЕННОСТИ
При наступлении беременности необходимо определить уровень ТТГ. Согласно рекомендациям АТА, при уровне ТТГ >2,5 мЕд/л беременные должны быть обследованы на наличие антител к ТПО. Беременным женщинам с эутиреоидным статусом и наличием АТ-ТПО или антител к тиреоглобулину (АТ-ТГ), следует измерять концентрацию ТТГ в сыворотке во время подтверждения беременности и каждые 4 недели до 20 недели беременности, далее в 30 недель.
Согласно Российским клиническим рекомендациям 2021 г., в которых представлены алгоритмы диагностики и лечения гипотиреоза при беременности, терапия L-тироксином рекомендуется женщинам с наличием АТ-ТПО и уровнем ТТГ >4 мЕд/л и <10 мЕд/л. При уровне ТТГ >10 мЕд/л женщине незамедлительно назначается заместительная доза L-тироксина из расчета 2,3 мкг/кг вне зависимости от наличия или отсутствия аутоантител к ткани ЩЖ (АТ-ТПО, АТ-ТГ). Заместительная терапия функции ЩЖ препаратами ТГ может быть рекомендована женщинам с наличием АТ-ТПО и уровнем ТТГ >2,5 мЕд/л и <4 мЕД/л и женщинам при отсутствии АТ-ТПО, но с уровнем ТТГ >4 мЕд/л и <10 мЕД/л (данный диагностический алгоритм представлен на рисунке 4).

ТАКТИКА ВЕДЕНИЯ ПАЦИЕНТОВ В ПОСЛЕРОДОВОМ ПЕРИОДЕ
В большинстве случаев после родов потребность в дозировке L-тироксина сразу снижается, поэтому целесообразно рекомендовать ту дозу препарата, которую женщина принимала до наступления беременности. Необходимо учитывать, что если у пациентки диагностирован АИТ, в связи с возможным прогрессированием аутоиммунного процесса в некоторых случаях, дозировка L-тироксина после родов может быть повышена по сравнению с той, которая была назначена до беременности. Оценку тиреоидного статуса проводят примерно через 4–6 недель после родов, далее – в зависимости от клинической ситуации.
Кроме того, одним из осложнений в послеродовом периоде является послеродовый тиреоидит. Послеродовый тиреоидит – синдром транзиторной или хронической тиреоидной дисфункции, в основе которого лежит аутоиммунное воспаление ЩЖ, встречающееся у 3–5% женщин в течение первых 12 месяцев после родов [24, 25].
Клиническая картина складывается из 2 последующих стадий. Гипертиреоидная фаза проявляется на 3-м месяце послеродового периода. Могут появиться симптомы тиреотоксикоза: повышенная раздражительность, плаксивость, учащенное сердцебиение, повышенная потливость. В этот период может быть ошибочно поставлен диагноз диффузно-токсический зоб. Гипотиреоидная фаза диагностируется на 6-м месяце послеродового периода. Стадия гипотиреоза может сохраниться до 3–4 месяцев. Лечение послеродового тиреоидита зависит от стадии заболевания и выраженности клинических симптомов. При тиреостатической фазе не используют тиреостатические препараты, с симптоматической целью назначают β-адреноблокаторы. Заместительную терапию L-тироксином следует проводить лишь при манифестном гипотиреозе.



