Инфицированность вирусом папилломы человека (ВПЧ) среди беременных женщин составляет от 5,5 до 65% [1]. Исследования влияния ВПЧ на частоту преждевременных родов (ПвР) и самопроизвольных выкидышей (СпВ) имеют неоднозначные результаты [2]. Сочетание ВПЧ с другими инфекциями достигает 70% [3], что приводит к изменениям количественного и качественного состава, а также свойств локальной микрофлоры и рассматривается в настоящее время как «дисбиоз» [4], при этом бактериальный вагиноз (БВ), аэробный вагинит (АВ) и вульво-вагинальный кандидоз (ВВК) увеличивают риск ПвР и СпВ [5–7]. По данным В.Н. Серова с соавт., 51% родов в сроке 28–33 нед. происходят на фоне влагалищной инфекции (p<0,01) [8]. Однако количество исследований среди беременных женщин с различными формами дисбиоза на фоне ВПЧ-инфекции ограничено и требует изучения.
Цель исследования – определить частоту и риск невынашивания и недонашивания беременности, а также оценить влияние прогестерона на снижение риска преждевременных родов у женщин с ВПЧ-инфекцией и рецидивирующими нарушениями биоценоза влагалища.
Материал и методы исследования
В исследование включено 220 беременных женщин (из них 195 – с ВПЧ-инфекцией и рецидивирующим дисбиозом влагалища и 25 – без них). На начальном этапе из исследования выбыло 50 пациенток с ВПЧ, не отвечавшие или соответствовавшие требованиям включения/исключения, и, таким образом, в исследовании приняли участие 145 пациенток с ВПЧ и дисбиозом.
В группы первого этапа исследования вошли 77 пациенток, среди которых проводилась оценка влияния рецидивирующего дисбиоза и эффективности его лечения на частоту СпВ и ПвР, а также определение риска преждевременных родов. Эти пациентки были разделены на две группы. В I группе (n=36) – получали лечение антисептиком (деквалиния хлорид) вагинально на ночь в течение 6 дней (разрешено к применению во время всего периода беременности) [9]. Во II (n=41) – после лечения с использованием деквалиния хлорида вводили вагинальные таблетки, содержащие лиофилизат ацидофильных лактобактерий 50 мг в сочетании с эстриолом 0,03 мг, по одной на ночь 12 дней (применение возможно во II–III триместрах беременности) [9], 25 беременных составили III группу (без ВПЧ и дисбиоза) для контроля результатов лечения дисбиоза.
Во второй этап включено 68 пациенток (IV группа) для оценки эффективности микронизированного прогестерона (праджисан) в профилактике ПвР, который вводили после санации влагалища (деквалиния хлорид + лиофилизат ацидофильных лактобактерий) по 200 мг в сутки с 18–30 (в зависимости от времени поступления под наблюдение) до 34 недели беременности [9]. Исходы беременности у пациенток этой группы сравнивали с теми, кто не получал прогестерон (n=77 – пациентки I и II групп суммарно), которые составили группу сравнения на втором этапе.
Критерии включения: возраст 21–45 лет; беременность во II-III триместре (18–30 нед.); наличие ВПЧ-инфекции; диагноз, соответствующий коду МКБ-10: N88 – другие невоспалительные болезни женских половых органов (бактериальный вагиноз – БВ), B37.3 – кандидоз вульвы и влагалища (вульво-вагинальный кандидоз – ВВК), N76.0 – острый вагинит (неспецифический, или аэробный вагинит – АВ); рецидивирующее течение (повторный эпизод заболевания в течение настоящей беременности); информированное добровольное согласие на участие в исследовании.
Критерии исключения: ПвР в анамнезе; инфекции, передаваемые половым путем без предварительной санации, многоплодие, тяжелые соматические заболевания, резус-отрицательная кровь, преэклампсия, установленная ранее аллергическая реакция на лекарственные средства, наличие противопоказаний к применению используемых препаратов. Пациентки с ПвР в анамнезе были исключены из исследования с целью исключить влияние этого фактора риска по досрочному завершению гестации на исходы настоящей беременности.
Для выявления ВПЧ использовали диагностику методом полимеразной цепной реакции (ПЦР) в режиме реального времени. Оценку клинической картины заболевания проводили на основании жалоб и объективного осмотра. Выполняли определение рН содержимого влагалища, микроскопию влагалищного содержимого, определяли общую бактериальную массу и наличие микроорганизмов в диагностически значимых количествах с помощью Фемофлор-16, цитологическое исследование мазков с шейки матки оценивали по классификации Bethesda system пересмотра 2015 года [10].
Критериями оценки эффективности лечения дисбиоза служили: отсутствие клинических и лабораторных признаков инфекции через 14 дней после лечения, отсутствие рецидивов на протяжении 3–4 месяцев (при этом 92,4% (134/145) пациенток, взятые под наблюдение в сроке до 28 недель гестации, подвергались контрольному обследованию до окончания срока гестации, остальные – после родов, но не ранее, чем через 6–8 недель после них).
Критериями оценки эффективности профилактики невынашивания и недонашивания беременности служили: частота СпВ в сроках до 210-6 нед. и частота ПвР – в сроки менее 330-6 нед. и менее 360-6 нед.
Статистический анализ данных выполнен с помощью статистических пакетов SAS 9.4, STATISTICA 12 и IBM-SPSS-24. При анализе количественных признаков проводилась проверка на нормальность распределения, вычисляли среднее арифметическое (М), стандартное отклонение (SD), дисперсию и 95% доверительный интервал (ДИ). При оценке качественных показателей вычислялись фактические и процентные частоты наблюдений (n, %). Статистическую значимость различий между двумя средними показателями оценивали с помощью непарного t-теста Стьюдента с поправкой Бонферрони (различия считали статистически значимыми при р≤0,05). Исследование взаимосвязи между парами качественных признаков проведено путем анализа парных таблиц сопряженности с вычислением критерия Пирсона (χ²) и интенсивности связи анализируемых признаков (V-коэффициент Крамера –VC).
Результаты исследования
Возраст беременных женщин с ВПЧ, включенных в исследование, варьировал от 21,3 до 44,5 лет. Данные анамнеза представлены в таблице 1.
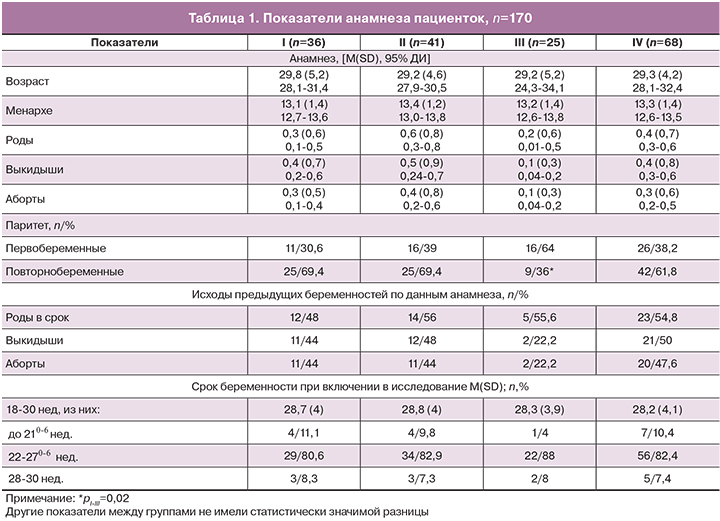
Большинство пациенток (80,6%) поступили под наблюдение в сроки 22–270-6 нед. Статистически значимых различий по образованию, социальному статусу, семейному положению, вредным привычкам, гинекологическому и акушерскому анамнезу, генитальным и соматическим заболеваниям не было.
У пациенток обнаружены преимущественно высокоонкогенные типы ВПЧ: 16 – у 28,3% (41/145), другие (суммарно) – у 53,8% (78/145) и низкого риска – у 17,9% (26/145).
С учетом полученных результатов динамики клинической картины и лабораторных показателей выздоровление после курса лечения констатировано у 83,3% (30/36) и у 90,2% (37/41) пациенток (р=0,23) I и II групп соответственно. Рецидивы в течение 3–4 месяцев наблюдения отмечены у 44,4% (16/36) и у 24,4% (10/41) соответственно (относительный риск ОР=1,6; 95% ДИ: 1,0–2,5; р=0,11), в их структуре преобладал БВ, сочетанный с аэробными микроорганизмами, грибы – не выявлялись.
Родами в срок завершилось 77,8% (28/36) беременностей в I группе, 75,6% (31/41) – во II (рI-II=0,96) и 100% (25/25) – в III (рI-III=0,03 и рII-III=0,02). Досрочное прерывание беременности наблюдалось у 25% (9/36) и у 24,4% (10/41; р=0,82) пациенток I и II групп соответственно. Структура досрочного завершения беременности представлена в таблице 2.
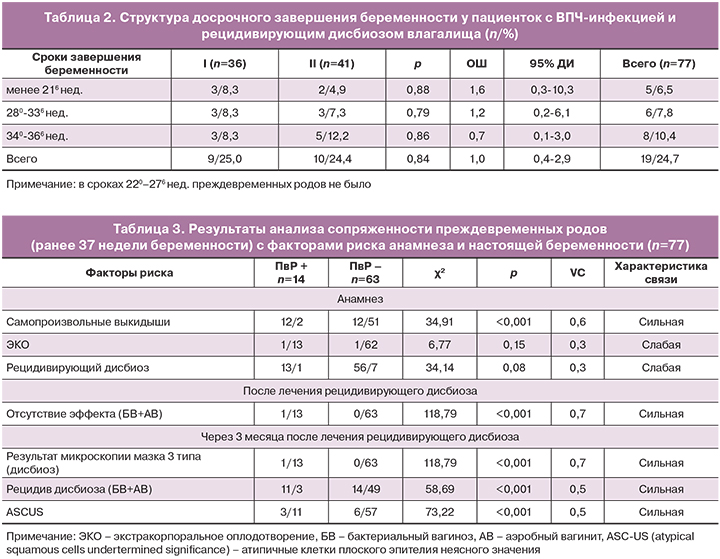
Из таблицы 2 видно, что статистически значимой разницы по срокам досрочного завершения беременности между группами не было. При этом частота преждевременного разрыва плодных оболочек (ПРПО) в обеих группах составила 50,6% (39/77) против 12% (3/25) в группе контроля (ОР=4,2; 95% ДИ: 1,4–12,5; р=0,001).
Результаты анализа сопряженности между исходами беременности (ПвР и СпВ) с факторами риска представлены в таблицах 3 и 4.

Результаты, представленные в таблице 3, демонстрируют сильную сопряженную связь ПвР с наличием в анамнезе СпВ и рецидивирующего дисбиоза, с отсутствием эффекта от лечения в течение настоящей беременности и рецидивами заболевания в контрольные сроки, а также изменениями эпителия шейки матки ASCUS.
Из таблицы 4 видно, что наличие рецидивирующего дисбиоза в анамнезе имело сильную связь с СпВ. Отсутствие эффекта после лечения и наличие рецидивов дисбиоза через 3–4 месяца после лечения, как по данным микроскопии мазка, так и Фемофлор-16 имели сильную сопряженную связь и с СпВ. Внимания заслуживают результаты анализа, касающиеся эпителиальных изменений шейки матки по данным цитологического исследования. LSIL были выявлены у 10,4% (8/77) пациенток и HSIL – у 1,3% (1/77). Эти изменения эпителия, свидетельствующие о персистенции ВПЧ, имели сильную сопряженную связь с СпВ до 22 недели. Такой закономерности не выявлено для ПвР. Однако сильная сопряженная связь отмечена для ПвР с поражениями эпителия ASCUS, которые обнаружены у 11,7% (9/77) пациенток. Особенности эпителия, обозначаемые ASCUS, свидетельствуют о реактивных изменениях в клетках шейки матки и косвенно – воспалительной реакции.
С учетом полученных результатов динамики клинической картины заболевания и лабораторных показателей выздоровление (отсутствие дисбиоза) после проведенного курса лечения у пациенток второго этапа исследования (IV группа), получавших микронизированный прогестерон, констатировано у 85,3% (58/68). Рецидивы в течение 3–4 мес наблюдения были отмечены у 38,2% (26/68).
В этой группе родами завершилось 92,7% (63/68) беременностей, прервалось до 22 недель – 7,3% (5/68), в группе сравнения – 93,5% (72/77) и 6,5% (5/77) соответственно; р=0,90). Влияния применения микронизированного прогестерона на исходы беременностей ранее 22 недель выявить не удалось, что можно объяснить недостаточным количеством пациенток, взятых под наблюдение во втором триместре (8 и 7 человек соответственно).
Таким образом, далее для изучения исходов беременностей в сроки более 22 недель оценка проводилась среди родивших 63 женщин, получавших прогестерон, и 72 – не получавших его (табл. 5).
Из таблицы 5 видно, что профилактический прием микронизированного прогестерона (праджисан 200 мг в сутки) позволил снизить на 70% риск досрочного завершения беременности (ОР=0,3; 95% ДИ: 0,07–0,8; р=0,02) у пациенток с ВПЧ-инфекцией и рецидивирующим дисбиозом влагалища по сравнению с пациентками, не получавшими профилактического лечения данным препаратом. При этом частота ПРПО составила 20,6% (13/63) против 50,6% (39/77) по сравнению с пациентками, не получавшими прогестерон (ОР=0,4; 95% ДИ: 0,2-0,7; р=0,001).
Обсуждение результатов
Инфицирование нижних отделов полового тракта у беременных женщин условно-патогенными микроорганизмами анаэробно-аэробной группы рассматривается как фактор риска ПРПО и досрочного завершения беременности [11–13]. Г.М. Савельева с соавт. отмечают, что одной из ведущих причин ПвР является инфекция половых органов (у 69% пациенток) [14]. Влияние БВ и других инфекций на частоту ПвР хорошо изучено и нашло отражение в многочисленных зарубежных и отечественных публикациях. В то же время, количество исследований исходов беременности при наличии ВПЧ ограничено, а при смешанных вирусно-бактериальных инфекциях – практически не изучено, и работ, посвященных этой теме, мы не встретили.
Результаты настоящего исследования показали, что лечение дисбиоза антимикробными средствами в комбинации с пробиотиком повышает его эффективность – элиминация возбудителей происходит у 90% пациенток и частота рецидивов ниже в 2 раза по сравнению с теми, кто не получал пробиотик. Тем не менее рецидивы в течение 3–4 месяцев наблюдения возникают с частотой 24%, что не отличается от результатов при использовании традиционных схем терапии (15–30% в первые 3 месяца после лечения [15]), причем в структуре нарушений преобладает БВ в сочетании с аэробной флорой.
Нами показано, что наличие у беременных женщин ВПЧ в сочетании с рецидивами дисбиоза ассоциированы с риском невынашивания и недонашивания беременности. Так, средняя частота ПвР составила 18,2% и СпВ – 6,5%, тогда как по оценкам в мировой популяции частота ПвР – 11,1 на 100 живорождений [16], а поздние потери беременности между 12 и 22 нед. – около 2–3% [17]. То есть, частота досрочных родов и выкидышей в исследуемой когорте в 1,6 и 2 раза соответственно превышала общий популяционный уровень. К аналогичному заключению пришли и авторы мета-анализа, где показано, что БВ увеличивает риск ПвР более чем в 2 раза, даже при отсутствии симптомов заболевания (у женщин без ВПЧ) [7].
На основании мета-анализа сделан вывод: «ни один антибиотический режим не предотвращает ПвР ранее 37 нед. у женщин с БВ (ОР=0,9; 95% ДИ: 0,7–1,1) [7, 18], но терапия БВ уменьшает риск СпВ (ОР=0,2; 95% ДИ: 0,05-0,8)» [19]. Положение об отсутствии эффекта терапии дисбиоза на частоту ПвР у пациенток с ВПЧ подтвердилось и в настоящем исследовании.
Так, в настоящем исследовании показано, что персистенция ВПЧ (о чем свидетельствует сильная сопряженная связь между LSIL/HSIL с СпВ) и воспалительная реакция тканей на фоне ASCUS (сильная сопряженная связь с ПвР) влияет на повышение риска досрочного завершения беременности.
Такое воздействие ВПЧ описано в систематическом обзоре 2017 г. Niyibizi J. с соавт. [20], где представлены данные экспериментальных исследований на беременных животных, которые показали, что ВПЧ может реплицироваться в трофобластах, что приводит к ингибированию образования бластоцисты, неудачной имплантации трофобластических клеток в эндометрий и апоптозу эмбриональных клеток. Помимо этих прямых эффектов, было высказано предположение, что взаимодействие ВПЧ с трофобластами может вызвать иммунную гиперчувствительность к бактериям, приводящим к ПвР [21]. Обзор 2480 клинических случаев выявил значительную корреляцию реактивных и атипичных цитологических изменений во время беременности с аномальными результатами плаценты и ПвР [22].
Савельева Г.М. с соавт. при рассмотрении вопроса об этиологии и патогенезе спонтанных ПвР указывают на изменения плодных оболочек (в том числе децидуальной), в основном воспалительного генеза с последующим преждевременным их разрывом вследствие повышенного выброса цитокинов на фоне инфекции полового тракта [13] и совпадает с данными других исследований [23].
По мнению З.С. Ходжаевой с соавт., у женщин с идиопатическими ПвР по сравнению со своевременными родами достоверно чаще отягощен инфекционный анамнез, а выявление клинико-анамнестических факторов дает возможность прогнозировать риск и обоснованно выбирать тактику ведения пациенток и профилактические мероприятия до развития клинических признаков угрожающих преждевременных родов [24].
Указанные выше сведения литературных источников и полученные в настоящем исследовании результаты послужили поводом для профилактики ПвР микронизированным прогестероном в группе второго этапа исследования, основаниями для чего явились данные анализа следующих материалов. Показанием к назначению микронизированного прогестерона, согласно инструкции по медицинскому применению препарата праджисан, является предупреждение (профилактика) ПвР у женщин из группы риска (с укорочением шейки матки и/или наличием анамнестических данных ПвР и/или преждевременного разрыва плодных оболочек) [9]. Факторы риска ПРПО хорошо изучены и описаны в отечественной и мировой литературе, и к ним среди прочих отнесены аномальные выделения из влагалища во время беременности (ОР=3,3; 95% ДИ: 1,7–6,6) [25] или генитоуринарные инфекции (включая бессимптомную бактериальную колонизацию), имевшие место, как в анамнезе, так и во время настоящей беременности [26]. По данным Gupta A. с соавт., среди женщин с БВ, ПРПО имеет место у 60,9% из них (против 14,3% – среди пациенток без БВ), а общая частота ПвР составляет 23,5% [11], что и подтверждено в настоящем исследовании. Существуют также данные о том, что лечение БВ, проведенное на сроке беременности менее 20 недель, может снизить риск ПвР [27, 28].
По данным мировой литературы эффективно назначение прогестерона в группе высокого риска (ПвР в анамнезе) и позволяет снизить повторные ПвР на 35–68% (уровень доказательности A-1a) [18, 29, 30]. З.С. Ходжаева с соавт. в многоцентровом исследовании МИСТЕРИ продемонстрировали статистически значимое снижение частоты ПвР в сроке менее 34 нед. беременности до 5,5% (p=0,003) у женщин с сонографически короткой шейкой матки и до 6,4% (p=0,003) – у беременных женщин с ПвР в анамнезе по сравнению с литературными данными (5,9%; p<0,001) [31].
Результаты исследования ТРИСТАН-2 подтвердили эффективность микронизированного прогестерона у пациенток с привычным невынашиванием, среди которых частота ПвР составила 8,9 и 9,6% (p>0,05) у пациенток, прошедших прегравидарную подготовку и без нее соответственно, что соответствует общепопуляционному уровню в мире [32].
В то же время в отношении группы риска ПРПО, сведения об эффективности прогестерона отсутствуют.
В данном исследовании мы исключили женщин с ПвР в анамнезе, однако положительное действие на течение беременности отмечено в когорте пациенток, получавших микронизированный прогестерон, среди которых риск ПвР оказался ниже на 70% по сравнению с теми, кто его не получал (р=0,02), а частота составила 4,8% в сроках менее 360-6 недель.
Возможные механизмы действия микронизированного прогестерона, вводимого вагинально, на продолжительность гестации можно объяснить прямым взаимодействием с рецепторами прогестерона (при этом концентрация прогестерона в матке существенно выше по сравнению с сывороткой крови), а также системным действием через метаболиты α и β: α-метаболит соединяется с ГАМК-рецепторами ЦНС, оказывая анксиолитическое и седативное действие, а также увеличивая концентрацию прогестерон-индуцированного блокирующего фактора (ПИБФ) который замедляет синтез провоспалительных цитокинов и простагландинов Th1-пакета, синтезирует «сохраняющий» пакет цитокинов Th2; β-метаболит оказывает токолитический эффект и блокирует экспрессию окситоциновых и простагландиновых рецепторов миометрия. Отмечается также снижение производства стимулирующих простагландинов и ингибирование экспрессии белков, связанных с сокращением миометрия [33, 34].
Однако на основании настоящего исследования невозможно судить о влиянии микронизированного прогестерона на частоту СпВ у женщин с ВПЧ и рецидивирующим дисбиозом влагалища ввиду небольшой выборки, что является ограничением данного исследования, и требует дальнейшего изучения.
Заключение
Таким образом, показано, что беременность, протекающая в условиях рецидивирующего нарушения биоценоза влагалища на фоне ВПЧ-инфекции, сопровождается высоким риском недонашивания беременности. Однако лечение рецидивирующего дисбиоза у пациенток с ВПЧ не снижает риск преждевременного родоразрешения.
Женщин с рецидивирующим течением дисбиоза влагалища на фоне ВПЧ-инфекции следует отнести в группу риска по преждевременным родам (вследствие высокого риска преждевременного разрыва плодных оболочек). Таким пациенткам показано профилактическое применение микронизированного прогестерона с целью предотвращения преждевременных родов (эффективность по критерию снижения относительного риска – 70%).



