Урогенитальные инфекции являются одной из актуальнейших проблем акушерства и гинекологии [1].
При беременности происходит функциональная супрессия адаптивного иммунитета [2], что может привести к активации условно патогенной флоры, персистирующей инфекции [3] и рождению ребенка с признаками внутриуробного инфицирования (ВУИ), несмотря на отсутствие выраженных клинических проявлений заболевания во время беременности. Специфическое лечение в данном случае не назначают, критерии прогноза раннего неонатального периода практически отсутствуют [4]. В этой связи перспективным представляется использование в прогностических целях сывороточных показателей белков, активно участвующих и в развитии беременности, и в воспалительных процессах. К их числу относятся регуляторно-транспортные белки: α2-макроглобулин (α2-МГ), полиспецифичный ингибитор протеиназ, активно участвующий в оплодотворении, имплантации эмбриона, в распознавании патогенов, контролирующий развитие и направленность воспалительной реакции [5]; лактоферрин (ЛФ), высокочувствительный реактант воспаления с выраженной антибактериальной и противовирусной активностью, участвующий в процессах оплодотворения и развитии беременности [6]; и альбумин (АЛБ) – белок-скавенджер, транспортирующий металлы, гормоны, жирные кислоты и пр.
Целью нашего исследования было изучение содержания α2-МГ, ЛФ и АЛБ в сыворотке крови и околоплодных водах (ОВ) у рожениц при носительстве возбудителей и антител к возбудителям TORCH-инфекций, для оценки их роли в развитии инфекционных осложнений раннего неонатального периода.
Материал и методы исследования
В исследовании участвовали 40 практически здоровых рожениц контрольной группы (38–40 недель гестации), 35 рожениц группы сравнения, являющиеся носительницами перечисляемых ниже возбудителей (группа смешанная, поскольку в проведенных ранее исследованиях зависимости от типа возбудителя не обнаружено), родивших здоровых доношенных детей (8 и более баллов по Апгар, без признаков ВУИ), а также 138 носительниц возбудителей или антител к возбудителям TORCH-инфекций, в том числе: 18 – Candida albicans, 23 – Staphylococcus aureus во влагалищных мазках, 40 – IgG антитела к Chlamydia trachomatis, 25 – IgG антитела к Herpes Simplex, а также 32 роженицы-носительницы микст-инфекции (2 и более из вышеперечисленных), родившие доношенных детей с признаками ВУИ, имевших в последующем осложненное течение раннего неонатального периода. Все включенные в исследование женщины-носительницы условно патогенной флоры и антител не имели клинических проявлений инфекции в течение беременности, признаков пороков развития плода по данным ультразвукового исследования. Носительство возбудителей и антител к возбудителям TORCH-инфекций установлено стандартными методами при скрининговом обследовании на TORCH-инфекции после получения информированного согласия. Для определения содержания α2-МГ в сыворотке крови применялся метод количественного ракетного иммуноэлектрофореза с использованием исследовательских тест-систем, сконструированных в НИЛ иммунологии ГБОУ ДПО НГИУВ. Уровень ЛФ в крови определяли методом твердофазного иммуноферментного анализа (ИФА) при помощи тест-систем ЗАО «Вектор-Бест». Уровни ЛФ и α2-МГ в ОВ определялись ИФА методом с использованием коммерческих тест-систем ЗАО «Вектор-Бест» и исследовательских тест-систем, сконструированных в НИЛ иммунологии ГБОУ ДПО НГИУВ соответственно. Содержание АЛБ в крови оценивалось колориметрическим методом с использованием коммерческих тест-систем (Spinreact, Испания), а в ОВ – методом количественного ракетного иммуноэлектрофореза. Для статистической обработки полученных данных применяли программу InStat 2.0 (GraphPad, США) – метод парного межгруппового сравнения показателей при помощи параметрического либо непараметрического теста, в зависимости от результатов проверки нормальности распределения признаков по критерию Колмогорова–Смирнова.
Результаты и обсуждение
Согласно полученным результатам, несмотря на отсутствие клинических проявлений заболевания в течение беременности и рождение здорового ребенка, средние значения уровня ЛФ в сыворотке крови рожениц при носительстве возбудителей или антител к возбудителям TORCH-инфекций, независимо от вида, были повышены (табл. 1).
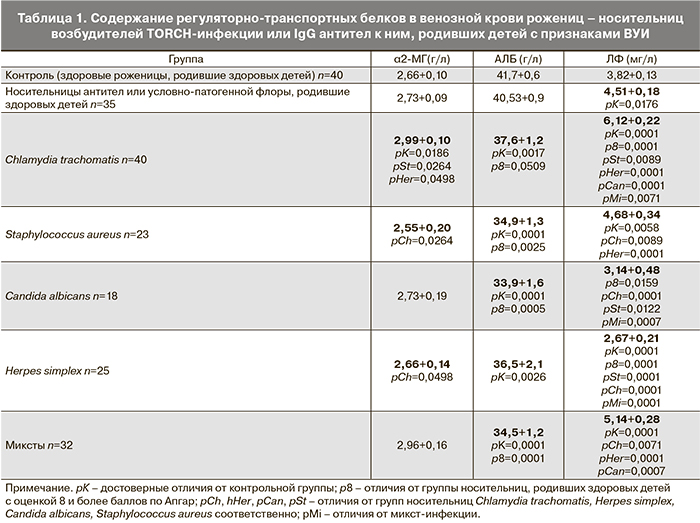
При этом наиболее высокими сывороточные концентрации белка были при рождении детей с ВУИ при наличии в мазках у матери St.aureus., и особенно – антител к Ch.trachomatis. У инфицированных C.albicans не было различий с контрольными показателями. При этом у носительниц H.simplex при рождении детей с признаками ВУИ наблюдались сниженные уровни ЛФ. Однако в целом, при микст-инфекции и рождении больных детей сывороточный уровень ЛФ в крови рожениц был выше, чем в контрольной группе, что совпадает с литературными данными [7]. Индивидуальный анализ показателей позволил установить, что при физиологической беременности у здоровых рожениц уровни ЛФ превышали 5,0 мг/л у 10% женщин. Содержание ЛФ менее 2 мг/л выявлено у 6% женщин. При рождении детей с признаками ВУИ уровни ЛФ >5,0 мг/л выявлялись в 80% случаев при носительстве антител к Ch.trachomatis, в 18% – при носительстве C.albicans, в 8% – при наличии в сыворотке крови высокоавидных антител к H.simplex и в 35% случаев при обнаружении St.aureus. Сывороточные концентрации ЛФ <2,5 мг/л при рождении ребенка с признаками ВУИ выявлены в 2% случаев при носительстве антител к Ch.trachomatis, в 5% при носительстве St.aureus, но при этом: в 45% случаев – при носительстве C.albicans и у 48% рожениц с антителами к H.simplex. В целом, можно заключить, что повышение содержания ЛФ в крови на поздних сроках беременности у носительниц возбудителей или антител к возбудителям TORCH-инфекции может расцениваться как фактор риска рождения больного ребенка в большинстве случаев. Исключение составляют носительницы грибов рода Candida и IgG-антител к вирусу простого герпеса.
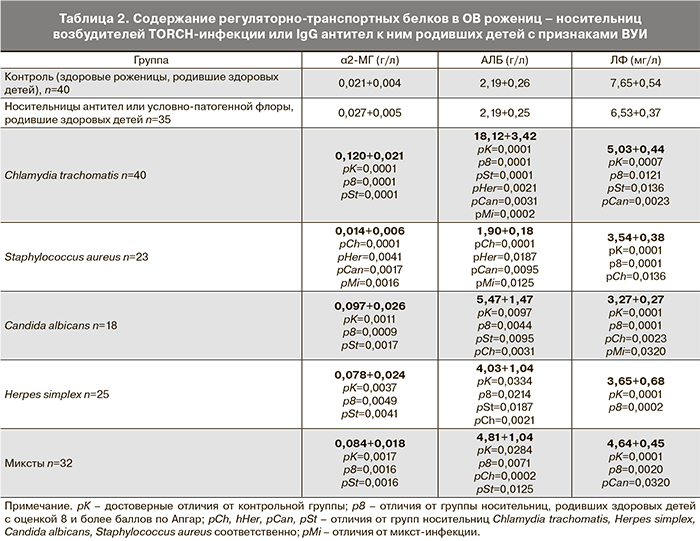
При физиологически протекающей беременности и рождении здорового ребенка уровень ЛФ в ОВ был фактически в 2 раза выше, чем в венозной крови. Это вполне объяснимо, учитывая, что значительная часть ЛФ синтезируется локально и служит одним из важных компонентов первичной защиты слизистых от патогенной инвазии [6]. В ОВ при рождении детей с признаками ВУИ содержание ЛФ у носительниц возбудителей или антител к возбудителям TORCH-инфекций было ниже, чем при физиологически протекающей беременности (табл. 2) – в 1,5 раза ниже при носительстве IgG антител к Ch.trachomatis в сравнении с контролем, в 2 и более раз при носительстве St.aureus, C.albicans или наличии высокоавидных IgG антител к H.simplex. Концентрации ЛФ <5 мг/л выявлялись у 10% здоровых рожениц, у 52% носительниц IgG антител к Ch.trachomatis, у 73% женщин с антителами к H.simplex, у 80% рожениц-носительниц C.albicans и 83% – St.aureus. Содержание ЛФ в ОВ при микст-инфекции и рождении больного ребенка было, в целом, таким же низким, как и при моноинфекции, что подтверждается результатами одних авторов [8] и противоречит результатам других [7]. Данные противоречия могут объясняться различной активностью воспалительного процесса – ЛФ является маркером острого воспаления [6], а мы изучали носительство без выраженных клинических проявлений, что более характерно для иммунодефицитных состояний со сниженной активностью локального синтеза компонентов врожденного иммунитета. Соответственно, при носительстве St.aureus и особенно носительстве антител к Ch.trachomatis содержание ЛФ в венозной крови было выше, чем в ОВ, а при кандидозе и носительстве антител к простому герпесу уровни были практически сопоставимы. Таким образом, носительство возбудителей TORCH-инфекций или антител к ним ассоциировано с локальным дефицитом ЛФ в зоне микроокружения плода, а увеличение его концентраций в крови на фоне развития воспалительных процессов не компенсирует этот недостаток при отсутствии выраженных клинических проявлений острого воспаления.
Концентрации α2-МГ в крови были относительно стабильными (табл. 1). Наряду с этим, выявлено достоверное повышение уровней α2-МГ у носительниц антител к Ch.trachomatis, родивших детей с ВУИ, что косвенно свидетельствует об увеличении количества дефектных форм данного регуляторного белка [5]. Концентрации α2-МГ>3,5 г/л обнаруживались в 12% в контроле, в 25% – при наличии антител к Ch.trachomatis, у 10% носительниц St.aureus, в 4% при носительстве антител к H.simplex. При носительстве C.albicans и микст-инфекции, при рождении больных детей, содержание α2-МГ имело тенденцию к накоплению, но без достоверных отличий от контроля из-за большой вариабельности показателей.
В ОВ (табл. 2) уровни α2-МГ были значительно выше нормативных показателей при рождении ребенка с признаками ВУИ и осложненным течением раннего неонатального периода, особенно у женщин с IgG антителами к Ch.trachomatis. Исключение составили носительницы St.aureus, что, вероятно, связано с тем, что при развитии ВУИ на фоне носительства St.aureus задействованы принципиально другие патогенетические механизмы, по сравнению с таковыми у носительниц антител к Ch.trachomatis. Уровни более 0,060 г/л в ОВ в контроле обнаруживались в 7% случаев, при носительстве антител к Ch.trachomatis – в 68% случаев, при обнаружении C.albicans или наличии антител к H.simplex – в 39 и 40% случаев соответственно, и только в 4% при носительстве St.aureus. В целом, содержание α2-МГ в ОВ было значительно ниже, чем в венозной крови, что объяснимо тем, что подавляющая часть этого белка синтезируется печенью [5]. Однако если в контроле и при носительстве золотистого стафилококка содержание α2-МГ в ОВ не превышало 1% сывороточных уровней, то при носительстве другой инфекции оно достаточно заметно увеличивалось, что свидетельствует об увеличении проницаемости фетоплацентарного барьера. Нами не обнаружено публикаций по изучению уровней α2-МГ в крови или в ОВ, позволяющих подтвердить либо опровергнуть данные выводы.
Установлено, что, несмотря на отсутствие клинических проявлений заболеваний, у носительниц патогенов и антител к ним, родивших детей с признаками ВУИ (моно- либо микст-инфекция) не только были повышены уровни ЛФ в крови, но и снижено содержание АЛБ (табл. 1), как по сравнению с контролем, так и с группой сравнения, что подтверждает наличие воспалительных процессов [1, 4], оказывающих негативное влияние на развитие плода.
Концентрация низкомолекулярного АЛБ в ОВ (табл. 2), как и содержание высокомолекулярного α2-МГ, была статистически достоверно повышена при носительстве C.albicans и H.simplex и практически в 10 раз выше нормы при наличии антител к Ch.trachomatis, но не отличалась от контрольных показателей и данных по группе сравнения при носительстве St.aureus. Уровни АЛБ в ОВ выше 5 г/л в контроле были у 7% рожениц, при наличии IgG антител к Ch.trachomatis – у 82%, при носительстве C.albicans – у 39%, при наличии антител к H.simplex – у 27% и ни в одном случае при носительстве St.aureus. В целом, содержание АЛБ в ОВ составляло около 5% его концентраций в венозной крови здоровых рожениц, однако при рождении больных детей при наличии антител к H.simplex или носительстве C.albicans соотношение изменялось, а при носительстве IgG антител к Ch.trachomatis составляло уже практически половину от сывороточного уровня. При микст-инфекции изменения были не столь выражены как у носительниц антител к Ch.trachomatis, родивших детей с признаками ВУИ, но отмечено достоверное повышение при сравнении с контролем и группой женщин-носительниц IgG антител к Ch.trachomatis, родивших здоровых детей. Поскольку эти изменения в целом совпадают с изменениями концентрации более крупного α2-МГ (720 кДа против 68 кДа), это подтверждает предположение об увеличении неселективной проницаемости фето-плацентарного комплекса, что может способствовать повреждению плода и инфицированию.
Заключение
При носительстве различных возбудителей TORCH-инфекции или IgG антител к ним без каких-либо клинических проявлений инфекции у беременной женщины и роженицы, рождение ребенка с признаками инфекции в большинстве случаев ассоциировано со значительно повышенными уровнями ЛФ и сниженным содержанием АЛБ в крови рожениц, что свидетельствует о наличии воспаления и может быть использовано в прогнозе течения неонатального периода. Повышенное содержание α2-МГ свидетельствует о риске инфицирования только при наличии IgG антител к Chlamydia trachomatis в крови матери.
В ОВ рожениц-носительниц различных возбудителей TORCH-инфекции или IgG антител к ним (кроме носительниц Staphylococcus aureus в виде моноинфекции) снижено содержание антибактериального и противовирусного ЛФ, что указывает на снижение местного синтеза белка и способствует уязвимости плода к любым возбудителям; а также повышено содержание α2-МГ и АЛБ, что свидетельствует об увеличении проницаемости фето-плацентарного комплекса, что также несет в себе риски заражения плодного яйца.



