Тяжелое и персистирующее маловодие в первые 22 недели может препятствовать развитию легких плода. При беременности, осложненной дефицитом амниотической жидкости (АЖ) на малых сроках, имеется риск задержки роста плода и асфиксии плода в родах [1]. Многоводие может свидетельствовать о декомпенсированном сахарном диабете у матери или анатомических дефектах у плода – атрезии пищевода, диафрагмальной грыже [2].
На поздних сроках беременности главным продуцентом АЖ является плод [3], в то время как на ранних сроках беременности точный источник АЖ неизвестен. Несмотря на попытки понять физиологическую регуляцию объема АЖ, многое остается неясным. Пути транспорта жидкости в амниотическую полость и из нее исследовались в экспериментах на животных, но основные клеточные события и медиаторы, регулирующие приток и отток АЖ, остаются неизвестными.
Цель обзора – описание современных представлений о путях образования и регуляции объема АЖ на поздних сроках беременности.
Оценка объема АЖ
Прямое определение объема АЖ
Для прямого определения объема АЖ применяется метод разведения. При этом во время амниоцентеза в плодный пузырь вводится краситель и после инкубационного периода 20–40 минут через ту же иглу или при повторном амниоцентезе забирается образец АЖ и измеряется степень разведения красителя. В качестве красителя применяются меченный радиоактивным йодом альбумин, конго красный, эванс голубой, кумасси голубой, кардиогрин и парааминогиппурат (ПАГ); наиболее точные результаты среди множества красителей показал ПАГ [4].
Методом разведения установлено, что объем АЖ нарастает параллельно темпам роста плода до 31–33 недель беременности, достигая величины 700–800 мл, затем практически не меняется до 39 недели, но после 40 недель при нормальной беременности объем АЖ снижается на 8% в неделю до 400 мл к 42 неделе беременности [3].
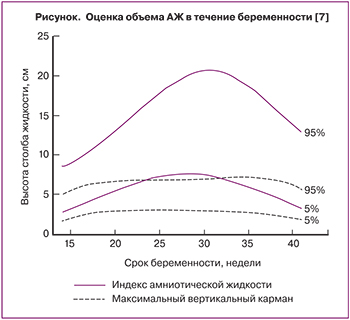 Ультразвуковое определение объема АЖ
Ультразвуковое определение объема АЖ
Наиболее часто используемыми сонографическими методиками определения объема АЖ являются максимальный вертикальный карман (МВК) и индекс АЖ. При МВК ≤2 см диагностируется маловодие, а при МВК ≥8 см – многоводие [5]. При оценке индекса АЖ амниотическую полость делят на четыре квадранта, где средняя линия живота является серединой [2].
Вертикальный столб жидкости в четырех квадрантах суммируется. При этом индекс АЖ ≤5 указывает на маловодие, а индекс АЖ ≥24 см – на многоводие [6]. Динамика величины МВК и индекса АЖ в течение беременности представлена на рисунке.
Исследования выявили корреляцию между индексом АЖ и МВК с реальным объемом АЖ у 50 пациенток с использованием ПАГ [2]. Однако обе сонографические методики переоценивали объем АЖ при малых объемах и недооценивали при больших.
Индекс АЖ и МВК используют для оценки объема АЖ при многоплодной беременности [7]. При этом необходимо, чтобы оболочки между плодами хорошо идентифицировались, а при оценке индекса АЖ также необходимо, чтобы была возможность разбить амниотический компартмент на квадранты.
Несмотря на ограничения, ультразвуковая оценка объема АЖ остается клиническим стандартом и используется для диагностики многоводия и при динамическом наблюдении. Оценка объема АЖ имеет важное значение для диагностики перинатальных осложнений.
Пути поступления и удаления АЖ
Для понимания регуляции объема АЖ требуется различать понятия интра- и трансмембранного всасывания. Процесс интрамембранного всасывания заключается в переносе воды и растворенных веществ через амнион в сосуды плода (у человека и других приматов через плодную поверхность плаценты), а трансмембранное всасывание АЖ осуществляется через амнион в кровоток матери [3].
АЖ образуется из мочи плода, секрета легких и носоглотки плода. Основными путями клиренса АЖ являются ее заглатывание плодом и всасывание через стенки сосудов плодной поверхности плаценты (интрамембранный путь). Потенциальными путями обмена между АЖ и материнской кровью является стенка матки (трансмембранный путь), кожа плода и пуповина, но последние два пути малоэффективны во второй половине беременности (таблица) [3].
Из возможных путей образования и оттока АЖ вклад в формирование объема АЖ у людей точно известен только для мочевого пути, который составляет приблизительно 30% массы тела в сутки [8]. Объем жидкости, заглатываемой плодом человека, оценен в единичных исследованиях [9]. Показано, что плод заглатывает приблизительно 17 мл/сут АЖ на сроке 20 недель беременности и 400–500 мл/сут перед родами. Таким образом, объем заглатываемой АЖ составляет 15–20% массы тела плода, что значительно меньше, чем вклад мочевого компонента [10, 11].

Секреция легкими изучалась у плодов овец и составляет приблизительно 300 мл, или 10% массы тела плода в сутки [9]. Секреция обеспечивается активным транспортом Cl– и пассивным транспортом Na+ и воды в дыхательные пути и регулируется катехоламинами, кортизолом и вазопрессином. Однако приблизительно 150 мл секретируемой легкими жидкости заглатывается плодом, поэтом вклад легких в формирование АЖ составляет примерно 5% массы тела плода в сутки.
Интрамембранные потоки также изучались у овец. Установлено, что при весе плода овцы 3 кг интрамембранная абсорбция составляет 200–400 мл/сут [12].
Секреция жидкости носоглоткой плода составляет 25 мл/сут при весе плода 3 кг или 1% массы тела плода в сутки [13]. Трансмембранный абсорбционный путь составляет 10 мл/сут [12].
У людей, в третьем триместре объем АЖ составляет 700—800 мл, при этом 1000 мл/сут поступает и столько же удаляется из амниона, поэтому даже небольшой дисбаланс этих потоков может вызвать олиго- или полигидрамнион в течение от 1 суток до 1 недели [12].
Регуляция объема АЖ
Объем АЖ тонко регулируется, однако сенсоры для объема АЖ не обнаружены. С другой стороны, поступление мочи плода, секреция жидкости легкими и заглатывание АЖ, а также интрамембранная проницаемость – процессы регулируемые. По-видимому, объем АЖ определяется взаимодействием этих потоков [3]. Другим путем регуляции объема АЖ может быть плацентарный перенос воды и растворенных веществ от плода и к плоду. Поскольку почки удаляют из организма плода большие количества воды и солей в АЖ, а дегидратация матери в течение нескольких дней снижает объем АЖ, то посредник между матерью и плодом – плацента – может быть главным органом, регулирующим объем АЖ [14].
Регуляция объема АЖ при гипоксии
Олигогидрамнион часто связан с задержкой роста плода и гипертензией у матери, поэтому традиционно считается, что гипоксия плода – главная причина олигогидрамниона. Однако, у беременных женщин на высоте 2000 м над уровнем моря индекс АЖ выше, чем у беременных женщин на уровне моря, а частота олигогидрамниона значительно ниже и частота полигидрамниона значительно выше у женщин на высоте 2000 м [15]. Таким образом, гипоксия плода обуславливает скорее полигидрамнион, чем олигогидрамнион, хотя механизмы этого феномена неясны. Примечательно, что у плодов овец, подвергнутых 24-часовой гипоксической гипоксии, поток мочи и объем заглатывания АЖ снижался. В течение 6 ч поток мочи нормализовывался, а заглатывание АЖ оставалось подавленным на всем протяжении действия гипоксии [3]. Таким образом, индуцированное гипоксией подавление заглатывания АЖ может опосредовать увеличение объема АЖ при длительной гипоксии.
У людей тяжелая анемия плода часто связана с полигидрамнионом. Возможно, это обусловлено повышением уровня лактата в плазме крови плода, который может действовать как осмотический агент и удерживает воду в амнионе. Кроме того, у животных инфузия молочнокислого натрия (но не NaCl) в кровь плода повышает объем АЖ [13], а у плодов овец с искусственной анемией в течение 7 дней также прогрессивно повышался уровень лактата в плазме крови с увеличением выделения мочи плодом в 2,4 раза от нормы и увеличением объема АЖ на 2050 мл выше, чем в контроле [16]. Таким образом, при секреции лактата в АЖ гипоксия плода вызывает скорее полигидрамнион, чем олигогидрамнион. Недавно предложена модель, в которой ключевая роль в индукции удаления АЖ из амниона приписывается васкулярному эндотелиальному фактору роста (VEGF), который может выделяться с мочой плода при гипоксии и стимулировать реабсорбцию компонентов АЖ и уменьшать объем АЖ [3, 17]. Очевидно, что взаимодействие двух разнонаправленных факторов – осмолита лактата и стимулятора реабсорбции АЖ VEGF при гипоксии плода вызывает диаметрально противоположные эффекты – полигидрамнион и олигогидрамнион.
Значение аквапоринов в регуляции объема АЖ
Механизм переноса жидкости через внутреннюю поверхность амниона может осуществляться не только посредством трансцитоза, стимулируемого VEGF, но также через аквапорины – специализированные белковые водные каналы [18]. Причем полиморфизм генов аквапоринов и нарушение их функционирования связывают с нарушением трансмембранного тока АЖ и многоводием [19].
У млекопитающих описаны 13 AQP, которые представлены в разных органах и тканях [20]. Аквапорины формируют специфические водные каналы, которые обеспечивают быстрое трансмембранное движение воды в ответ на осмотические или гидростатические градиенты [21].
Получены косвенные доказательства участия аквапоринов в плацентарном токе жидкости [22]. В плаценте и оболочках плода человека экспрессируются AQP1, 3, 4, 8 и 9. AQP1 локализуется в хорионе, амнионе и сосудах плаценты [23]. мРНК AQP1 обнаружена в плаценте мышей и овец, протеин AQP1 – в оболочках плода на всем протяжении беременности человека [19].
В плаценте человека AQP1 обнаружен в эндотелии сосудов плаценты, но не в трофобластах [23]. Экспрессия AQP1 в сосудах плаценты указывает на их роль в ангиогенезе [24]. По-видимому, AQP1 играет ключевую роль в движении воды из полости амниона через амнион и хорион прямо в сосуды плода. Экспрессия AQP1 возрастает в 33 раза в амнионе при беременности, осложненной идиопатическим многоводием, что может быть компенсаторной реакцией на увеличение объема АЖ [25]. В трофобластоподобных клетках экспрессию гена AQP1 повышают вазопрессин и агонисты цАМФ [26].
Экспрессия и активация AQP1, 3, 8 и 9 в плаценте и оболочках плода может быть адаптивным ответом на изменение объема АЖ, поскольку через аквапорины может удаляться вода и растворенные вещества из полости амниона в сосуды плода через амнион и хорион [25].
Заключение
Используемые в настоящее время непрямые методы определения объема АЖ (индекс АЖ, МВК) диагностически значимы только при умеренных изменениях объема АЖ и не позволяют достаточно точно оценить полигидрамнион и олигогидрамнион. Прямое же определение объема АЖ по степени разведения введенного в амниотическую полость красителя ввиду сложности процедуры и высокого риска осложнений применяется только при проведении научных исследований.
За последние годы изучения механизмов формирования и удаления АЖ накоплен большой фактический материал, который получен преимущественно в экспериментах на животных. Однако, взаимодействие осмотических и гидростатических сил с пара- и эндокринными факторами, а также активность и экспрессия аквапоринов в регуляции объема АЖ существенно осложняют построение единой модели регуляции объема АЖ и требуют дальнейшего детального изучения.



