Главной целью применения любого метода диагностической микробиологии является быстрая и точная идентификация бактерий в их естественной среде. Это особенно важно для диагностики бактериального вагиноза (БВ) – полимикробного биопленочного вагинального синдрома, характеризующегося высокой распространенностью, высокой частотой рецидивов и связанных с ними осложнений, включая преждевременные роды, бесплодие и более высокий риск развития инфекций, передающихся половым путем [1].
Микроскопические методы являются первым этапом диагностики инфекций репродуктивного тракта. С использованием красителей (окраска по Граму, метиленовым синим) оценивают микробиоценоз гениталий с определением количества лейкоцитов, эпителия, соотношения лейкоцитов и эпителиальных клеток, слизи и морфотипов бактерий [2]. Эти методы быстрые и дешевые, сочетающие прямую визуализацию и ориентировочную характеристику бактерий на основе строения их клеточной стенки. Из-за того, что существует малое разнообразие морфологических различий между множеством бактерий, микроскопические методы не позволяют провести надежную идентификацию микроорганизмов.
Методы на основе культивирования требуют много времени и во многом являются избирательными, особенно в отношении прихотливых или трудно культивируемых бактерий. Кроме того, данный подход не отражает точного состава смешанных бактериальных сообществ или микробного разнообразия при различных инфекциях, что является важным моментом при БВ [3]. В последние годы молекулярные методы, такие как полимеразная цепная реакция (ПЦР) и последующая гибридизация или секвенирование, произвели революцию во всех областях микробиологии. Стало возможным количественное обнаружение и точная идентификация бактерий, в том числе и ассоциированных с БВ. Эти методы уже широко и успешно используются в клинической микробиологии для обнаружения медленно растущих организмов или микроорганизмов, которые трудно культивировать (Megasphaera spр. типы 1 и 2, Dialister spр. типы 1–3, Eggerthella spр. тип 1). Однако эти методы не дают полной информации о морфологии, количестве и пространственном расположении микроорганизмов и клеток.
Метод флуоресцентной гибридизации in situ (FISH) сочетает в себе точность молекулярной генетики и информативность микроскопии, что позволяет визуализировать взаимосвязи между бактериями в их естественной микросреде обитания, такой как биопленка при БВ.
В таблице представлены используемые методы диагностики БВ и их характеристики [4].
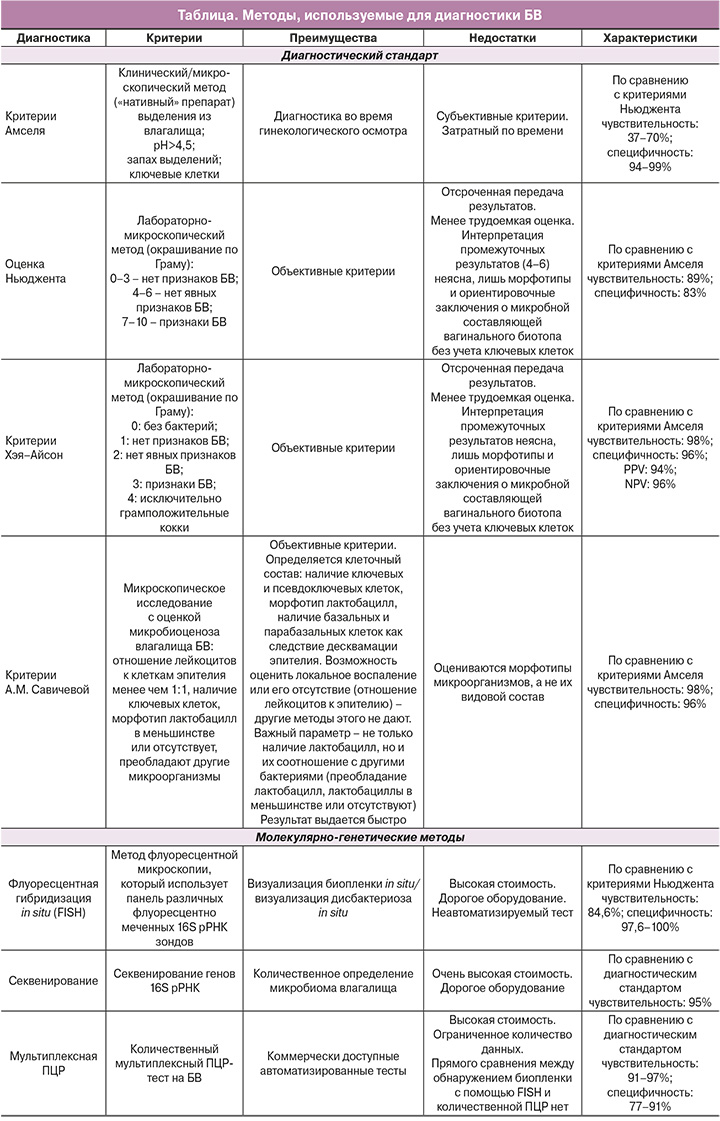
Метод FISH (метод флуоресцентной микроскопии) использует панель различныx флуоресцентно меченныx 16S рРНК зондoв для визуализации биопленки in situ и визуализации дисбактериозa in situ, что позволяет быстро и точно установить диагноз биопленочного вагиноза и небиопленочного вагиноза. Иными словами, метод позволяет сразу установить диагноз рецидивирующего вагиноза с образованием биопленок, при котором нужна двухэтапная, а иногда и трехэтапная терапия с разрушением биопленок, назначением антибактериальных препаратов и далее – пробиотических препаратов. С другой стороны, если в препарате выявляются рассеянные микроорганизмы, не образующие биопленки или формирующие ложные биопленки в виде псевдоключевых клеток (что, например, образуют лактобациллы, такие как L. iners), это может быть небиопленочный вагиноз, который не рецидивирует, и в этой ситуации терапия будет совсем другой.
При проведении этого исследования можно определять сразу разные виды микроорганизмов, генотипы гарднерелл, например, а также их отношение друг к другу и к эпителиальным клеткам и определять, находятся они в адгезивном или рассеянном состоянии.
История изучения вопроса
Метод гибридизации in situ, FISH, был разработан двумя исследовательскими группами независимо друг от друга [5, 6]. Исследователи описали новый подход к окрашиванию препаратов, основанный на комплементарном связывании нуклеотидного зонда, меченного радиоактивной меткой со специфическими мишенями – последовательностями нуклеиновых кислот внутриклеточных структур. Этот метод позволил исследовать последовательности нуклеиновых кислот внутри клеток без разрушения структуры самой клетки или нарушения целостности ее органоидов. Со временем метод гибридизации in situ совершенствовался, сфера применения метода расширялась, его использовали как для изучения эволюции хромосом, так и для анализа хромосом в целом, в том числе и для диагностики различных онкологический заболеваний, а также метод нашел широкое применение в цитогенетических исследованиях. Окончательно метод был введен в бактериологию в 1988 г., когда были использованы радиоактивно меченные рРНК-направленные олигонуклеотидные зонды для микроскопического обнаружения бактерий [7]. С помощью этой технологии в 1990-х гг. была описана идентификация Mycobacterium leprae и Helicobacter pylori в биоптатах тканей. Кроме того, метод гибридизации in situ широко применялся для демонстрации вирусов внутри клеток, включая такие вирусы как: вирус папилломы человека, герпеса, ветряной оспы, цитомегаловирус, вирус Эпштейна–Барр, а также вирусы герпеса 6 и 8 типов, вирусы гепатита B и C, вирус иммунодефицита человека, полиомавирус человека 2 (вирус JC), аденовирусы и парвовирус B19 [8].
С введением в исследования меток, меченных флюорохромом, радиоактивные метки неуклонно были вытеснены неизотопными красителями. По сравнению с радиоактивными, флуоресцентные зонды более безопасны, они обеспечивают лучшее разрешение и не требуют дополнительных шагов в методике обнаружения. Кроме того, флуоресцентные зонды могут быть помечены красителями с различной длиной волны излучения, что позволяет обнаруживать несколько последовательностей-мишеней на одном этапе гибридизации [9].
Первое применение FISH было описано в 1980 году, когда был использован 3’-флуоресцентно-меченный РНК-зонд для специфического связывания ДНК [10]. Высокая фоновая флуоресценция из-за неспецифической конъюгации зондов с длинными фрагментами была серьезной проблемой в первые годы применения метода FISH. В 1987 г. в качестве решения этой проблемы была описана, так называемая, «гибридизация с подавлением» путем предварительной обработки немечеными зондами нуклеиновых кислот, которые конкурируют за сайты неспецифического связывания. Далее было продемонстрировано, что «отношение сигнал/шум» может быть улучшено за счет уменьшения размера зонда [11].
Позднее была продемонстрирована мультиплексная способность технологии FISH с использованием двух- и трехцветной детекции флуоресцентно-окрашенных зондов на одном препарате, расширяя спектр идентификации различных агентов, что, вероятно, и послужило причиной популяризации метода с увеличением количества цитирований в системе PubMed с пометкой «FISH» с менее чем 100 за год до более чем 2000 за такой же период [9].
Принцип и методика выполнения флуоресцентной гибридизации in situ
FISH – цитогенетический метод, позволяющий идентифицировать микробные организмы-мишени (бактерии, дрожжеподобные грибы и простейшие) на уровне рода или вида. Результат комплементарного связывания (гибридизации) коротких, обычно размером от 18 до 25 базовых пар олигонуклеотидных зондов-мишеней, меченных флуорохромом, с рибосомальной РНК интактной клетки учитывается с помощью флуоресцентного микроскопа.
Для визуализации FISH используют флуорохромные красители. К флуорохромам первого поколения, применяемым для установления меток на зонды, относятся: производные флуоресцеина (флуоресцеин-изотиоцианат, FITC), производные родамина (тетраметил-родамин-изотиоцианат, TRITC), 5-(-6-)-карбоксифлуоресцеин-N-гидроксисукцимид-сложный эфир (FluoX) и аминометилкумаринацетат (AMCA). Современные флуорофоры, такие как цианиновые красители Cy3 или Cy5, обладают рядом преимуществ по сравнению с флуоресцирующими молекулами первого поколения. Так, зонды, меченные Cy3, обладают и достаточной интенсивностью свечения, и стойкостью к обесцвечиванию со временем. Свечение красителя Cy5 дает возможность выбора при мультиокрашивании препаратов, но находится в той спектральной части, которая не улавливается человеческим взглядом, а, значит, требует дополнительной обработки изображений. Зонды, меченные флуорохромом Cy3, легко комбинируются с зондами, меченными FluorX, хотя те и являются менее чувствительными [9].
В микробиологических исследованиях наиболее оптимальной является комбинация четырех флуорохромов: FITC как наиболее часто используемого, цианиновых красителей Cy3 и Cy5 как более устойчивых к выцветанию и DAPI – для контрастирования клеточных ядер эукариотов. Эти четыре флуорохрома можно применять одновременно, используя наборы специфических фильтров [12].
На рисунках 1 и 2 представлены микрофотографии с использованием разных зондов, меченных FITC, и цианиновыми красителями Cy3 и Cy5, а также DAPI – для контрастирования клеточных ядер эукариотов.
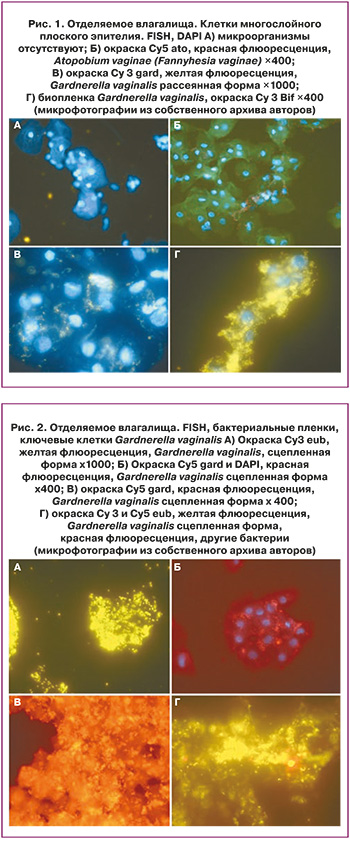
Применение метода флуоресцентной гибридизации in situ для диагностики рецидивирующего бактериального вагиноза
БВ является наиболее распространенным вагинальным заболеванием, выявляющимся у 30% женщин во всем мире [13]. БВ ассоциирован с повышенным риском возникновения широкого спектра гинекологических и акушерских осложнений, включая преждевременные роды, самопроизвольный аборт, потерю беременности на ранних сроках при ЭКО, а также инфицирование и передачу ВИЧ/ИППП [14–17]. БВ характеризуется изменением состава вагинальной микрофлоры, при котором уменьшается количество протективных Lactobacillus spp. и происходит взрывной рост облигатных или факультативно-анаэробных микроорганизмов, которые ранее составляли меньшинство в структуре микробиома влагалища. Это такие микроорганизмы как Gardnerella vaginalis, Fannyhessea (Atopobium) vaginae, Ureaplasma urealyticum, Mycoplasma hominis, Prevotella, Peptoniphilus, Megasphaera, Mobiluncus, а также некоторое количество трудно культивируемых или совсем некультивируемых бактерий (БВ-ассоциированные бактерии) [18]. Неизвестно, что является «спусковым» крючком, вызывающим характерный для БВ чрезмерный рост анаэробных бактерий, но эти изменения всегда происходят на фоне повышения рН экосистемы влагалища.
Традиционно, лечение БВ проводится препаратами группы 5-нитроимидазолов (метронидазол, клиндамицин), обладающих широким антимикробным действием. Препараты вводятся по схеме перорально и интравагинально, достаточно эффективны и излечивают около 70–85% женщин с установленным диагнозом БВ в течение 1 месяца [19, 20]. Однако более чем у 50% пациентов наблюдается рецидив симптомов БВ в течение 6 месяцев и более чем у 70% – в течение 12 месяцев [21, 22].
Частые рецидивы заболевания или рецидивирующий БВ требует особого внимания, так как до сих пор нет точного понимания развития патогенеза не только первого эпизода БВ, но также и его повторных случаев. Кроме того, повторное возникновение заболевания усугубляет стресс и разочарование женщин, вынужденных повторно обращаться в лечебные учреждения или даже заниматься самолечением [23]. К возможным предрасполагающим факторам развития рецидивов БВ относят: персистирование биопленки, связанной с БВ, неудачи в реколонизации влагалища лактобациллами, повторное заражение от не пролеченного партнера и какие-либо генетические и/или иммунные факторы организма хозяина [24].
Персистенция биопленки, состоящей из ассоциированных с БВ микроорганизмов является одним из самых вероятных путей возникновения рецидивов заболевания. Именно образованием биопленки можно объяснить нарушение гомеостаза микробиоты влагалища в виде повреждения эпителиального слоя, приводящее к повышению биодоступности тканей для различных патологических агентов, неудачи в антимикробной терапии, а также возможность передачи партнеру недолеченной биопленки. Как известно, бактериальные биопленки представляют собой скопления бактерий, которые прикреплены к поверхности и/или друг к другу и встроены в самопродуцируемый матрикс. В дополнение к защите, обеспечиваемой матриксом, бактерии в биопленках могут использовать несколько стратегий выживания для уклонения от защитных систем хозяина. Внутри биопленки бактерии приспосабливаются к ограничению питательных веществ, демонстрируя измененный метаболизм, экспрессию генов и выработку белка, что может привести к более низкой скорости метаболизма и снижению скорости деления клеток [25]. Кроме того, эти механизмы приспособления делают бактерии более устойчивыми к противомикробной терапии, инактивируя мишени противомикробных препаратов или снижая потребность в тех функциях клеток, которым эти противомикробные препараты мешают [26].
Недавно представленная обновленная концептуальная модель патогенеза БВ построена на основе потенциальной синергетической связи между G. vaginalis, P. bivia, F. vaginae (Atopobium vaginae) [27]. G. vaginalis, являясь микроаэрофилом и факультативно-анаэробным микроорганизмом, обладает способностью переносить высокий окислительно-восстановительный потенциал, создаваемый лактобациллярной вагинальной микробиотой; таким образом спокойно сосуществует вместе с ними. После полового контакта, вирулентные штаммы Gardnerella spp. вытесняют вагинальные Lactobacillus spp. и начинают формировать биопленку на вагинальном эпителии. Затем к биопленке гарднерелл присоединяется P. bivia, и активируется синергетическая связь между микроорганизмами. В результате протеолиза гарднерелл образуются аминокислоты, которые усиливают рост P. bivia, а аммиак, продуцируемый P. bivia, стимулирует рост Gardnerella spp. Кроме того, эти 2 бактерии продуцируют фермент сиалидазу, которая разрушает муциновый слой вагинального эпителия. В результате деградации защитного слизистого слоя повышается адгезия других ассоциированных с БВ бактерий к биопленке, в том числе F. vaginae. Роль других бактерий в патогенезе развития БВ на данный момент остается неизвестной и требует дальнейшего изучения [27].
Таким образом, наличие высокоструктурированной полимикробной биопленки на вагинальном эпителии является важным диагностическим маркером БВ. Присутствие биопленки было обнаружено у 90% вагинальных биоптатов, отобранных у женщин с установленным диагнозом БВ [28, 29]. Интересно с точки зрения диагностики БВ, что с начала 1980-х гг. одним из клинических критериев этого заболевания было наличие, так называемых, «ключевых клеток» (эпителиальных клеток, плотно покрытых бактериями) в нативном препарате [30]. И только спустя 30 лет при использовании FISH – технологий стало понятно, что «ключевые клетки» – это слущенные эпителиальные клетки, покрытые микроорганизмами, являющимися частью биопленок [31]. Именно использование методик на основе FISH помогло пониманию пространственной структуры и строения этих образований. Биопленки были описаны как сплошной слой плотно прикрепленных к поверхности вагинального эпителия коротких, почти кокковидных палочек (Gardnerella spp.) [31].
Совсем недавно проведенные исследования с использованием методов FISH принесли новые данные о термине «ключевая клетка» как части бактериальных пленок. Авторами была показана неоднородность среди адгезированных микроорганизмов в препаратах отделяемого влагалища, где были идентифицированы «ключевые клетки» с помощью рутинной микроскопии. На основе таксономической принадлежности бактерий методом FISH была выявлена высокая дифференциация бактериального покрова, формирующаяся принципиально различными способами. Для одной характерен адгезионный рост конгломератов гарднерелл на поверхности эпителиальных клеток, что приводит к появлению истинных «ключевых клеток», в то время как «псевдоключевые клетки» формируются в результате осадочного роста обособленно расположенных бактериальных групп в вагинальной слизи. Эти группы, как предполагают авторы, просто обволакивают эпителиальные клетки в областях избыточного роста микроорганизмов. Соответственно, только характерный рост адгезированных конгломератов гарднерелл на поверхности эпителиальных клеток представляет собой рост биопленки, и авторы предлагают называть это состояние биопленочным вагинозом, а второе состояние – БВ или дисбактериозом [32]. В результате своих исследований авторы получили лишь 56% подтвержденных, или истинных, «ключевых клеток». Как предполагают авторы, это расхождение в выявлении «ключевых клеток» может быть объяснением наблюдаемых ранее несоответствий в результатах клинических исследований в отношении передачи заболевания половым путем, тяжести и частоты сопутствующих осложнений, а также отсутствия терапевтических результатов у женщин с БВ [27, 33].
Первые доказательства, подтверждающие роль передачи БВ половым путем, появились еще в 1950-х гг., когда Gardner H.L. и Dukes C.D. впервые охарактеризовали БВ [34]. И хотя при переносе вагинальных выделений от женщин с БВ к здоровым женщинам у большинства развились клинические признаки и микробиологические особенности заболевания, единственный «подозреваемый» на место этиологического агента – Gardnerella vaginalis, подтверждающий инфекционный характер заболевания, согласно постулатам Коха, этим постулатам не соответствовал [34, 35]. Несмотря на то что Gardnerella vaginalis, впервые описанная Gardner H.L. и Dukes C.D. как Haemophilus vaginalis, обнаруживается практически у всех женщин с этим заболеванием, достаточно часто ее выявляют у женщин с физиологическим микробиоценозом влагалища [27, 36]. Этот факт долгое время ставил под сомнение вирулентный потенциал гарднерелл [37]. Тем не менее, в последнее десятилетие было продемонстрировано, что G. vaginalis обладает значительно более высоким потенциалом вирулентности, чем многие другие виды, ассоциированные с БВ, что определяется более высокой начальной адгезией и цитотоксическим эффектом, а также большей склонностью к образованию биопленки [38, 39]. Кроме того, ключевую роль вирулентных гарднерелл в развитии БВ доказывают исследования Swidsinski A., где было обнаружено, что G. vaginalis может существовать в виде двух форм: связанной (конгломераты) и дисперсной формы (одиночные бактерии). В связанной форме огромное количество гарднерелл было прикреплено к эпителиальным клеткам и обнаруживалось у всех пациентов с подтвержденным БВ и их партнеров. Одиночные гарднереллы находились среди общей массы других микроорганизмов и были выявлены не только у здоровых женщин, но также и у мужчин, и даже у детей, что тоже является косвенным доказательством полового пути передачи БВ [40]. Кроме того, патогенные штаммы продемонстрировали более высокие фенотипические уровни признаков вирулентности in vitro, таких как цитотоксичность, адгезия и образование биопленки, чем комменсальные штаммы [37]. Это, в свою очередь, указывает на генетические различия между патогенными и комменсальными штаммами G. vaginalis.
Недавние разработки в области молекулярной генетики пролили новый свет на генетическую гетерогенность и таксономическое разнообразие внутри рода Gardnerella. Исследователи указали на существование как минимум 13 групп, достаточно отличных друг от друга, чтобы их можно было классифицировать как отдельные виды, в пределах таксона, ранее известного как G. vaginalis. Хотя эти виды гарднерелл могут быть близкородственны генетически, лишь некоторые из них (патогенные) могут быть ассоциированы с таким заболеванием, как БВ, а непатогенные виды могут быть обнаружены у здоровых женщин [41]. Таким образом, именно патогенные виды гарднерелл могут инициировать образование биопленки на эпителиальных клетках влагалища, а роль других микроорганизмов в развитии БВ требует дальнейшего изучения [18, 27].
Таким образом, для диагностики БВ, особенно его рецидивирующих форм, ведется поиск быстрых и надежных методов. FISH – это метод флуоресцентной микроскопии, который позволяет провести таксономическую идентификацию и оценить пространственноe расположениe микроорганизмов. Благодаря фоновой флуоресценции можно определить морфологию исследуемого материала, клеточный состав, структуру ткани, лейкоциты. 16S рРНК, присутствующая в рибосомах бактериальных клеток в большом количестве копий (103–105), содержит как видоспецифические, так и группоспецифические или универсальные бактериальные участки. Для диагностики БВ используется панель с различными флуоресцентно-меченными зондами, которая включает соответствующие патогены/группы патогенов, такие как Gardnerella spp., F. vaginae, Bifidobacteriaceae, лактобациллы или бактерии в целом (Eubacteria). Зонды, меченные разными красителями, можно использовать для одномоментного исследования с использованием флуоресцентного микроскопа (многоцветный FISH) и определения среди группы микроорганизмов определенных видов. FISH подходит для исследования вагинальных проб, помещенных в жидкую транспортную среду, осадка мочи, а также биоптатов эндометрия, абортного материала или эякулята [42].
Заключение
Использование метода FISH позволит не только изменить представление о патогенезе БВ, но и выявить этиологический агент у каждой конкретной женщины, диагностировать биопленочный/небиопленочный вагиноз, определив пространственное отношение бактерий друг к другу и к эпителиальным клеткам, прогнозировать развитие рецидива заболевания и с учетом этого подбирать соответствующую терапию.



