Функциональный слой эндометрия циклически претерпевает процессы регенерации, секреторной трансформации и отторжения в течение менструального цикла в ответ на воздействие стероидных гормонов. Конечная цель этих физиологических изменений состоит в обеспечении восприимчивого к имплантации эмбриона статуса эндометрия и синхронизации процессов созревания бластоцисты и тканей эндометрия. Имплантация бластоцисты осуществляется в строго определенный период «окна имплантации», соответствующий 7–8-му дню после пика лютеинизирующего гормона (ЛГ), у женщин с 28-дневным менструальным циклом обычно на 19–21-й день менструального цикла. Однако исследования последних лет продемонстрировали, что в связи с индивидуальными физиологическими особенностями организма женщин возможны сдвиги «окна имплантации», которые могут приводить к снижению эффективности программ вспомогательных репродуктивных технологий (ВРТ) [1–3].
Морфологические изменения эндометрия на протяжении менструального цикла описаны R.W. Noyes более 60 лет назад и широко используются до настоящего времени. Критерии R.W. Noyes, используемые для диагностики нарушений секреторной трансформации эндометрия, основаны на таких морфологических параметрах, как наличие вакуолей, отек стромы, секреция желез и др. в соответствии с днями менструального цикла [4, 5].
Однако их точность поставлена под сомнение в рандомизированных исследованиях [1, 2]. Поэтому в настоящее время определение состоятельности секреторной трансформации эндометрия с помощью гистологического исследования структуры функционального слоя эндометрия является недостаточным и должно дополняться новыми высокоинформативными методами оценки рецептивности эндометрия.
В последние годы были проведены исследования глобальных транскриптомных профилей генов в различных условиях, оказывающих влияние на качественное состояние эндометрия. Исследования с применением микроматричного анализа продемонстрировали несостоятельность концепции универсального соответствия стадии «окна имплантации» 19–21-му дню менструального цикла. У каждой четвертой пациентки с неудачными попытками экстракорпорального оплодотворения (ЭКО) происходит смещение окна имплантации на 2–3 дня, что имеет фатальные последствия для реализации программы ВРТ [3].
Основным результатом проведенных исследований глобальных транскрипционных профилей генов стала идентификация наиболее информативных маркеров стадии «окна имплантации», часть из которых уже вошла в список «золотого стандарта» рецептивности эндометрия [6, 7].
На практике альтернативой дорогому, трудоемкому и дающему избыточную информацию методу микроматричного анализа может быть метод количественной обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР). Для определения персонального «окна имплантации» у женщин с неудачными попытками в программе ЭКО может оказаться достаточным исследование десятка генов с помощью ОТ-ПЦР в режиме реального времени – метода, не уступающего по чувствительности и специфичности микроматричному анализу, но более доступного для рутинного использования.
Цель данной работы состояла в повышении эффективности определения функционального состояния эндометрия периода «окна имплантации» на основе интегральной оценки транскриптов генов как маркеров готовности эндометрия к имплантации эмбриона.
Материал и методы исследования
В исследование включена 71 женщина репродуктивного возраста (до 39 лет) с регулярным менструальным циклом, без патологии эндометрия, с реализованной репродуктивной функцией. Первую группу составили 47 пациенток с трубно-перитонеальным фактором бесплодия, реализовавших репродуктивную функцию в программе ЭКО и обратившихся для проведения повторной программы ЭКО. Вторую группу составили 24 женщины с нормальной репродуктивной функцией, обратившихся с целью подбора средств контрацепции.
Пайпель-биопсия эндометрия выполнялась амбулаторно с помощью аспирационной кюретки «Pipelle de Cornier» (Laboratorie C.C.D., Франция) в естественном менструальном цикле, предшествующем стимуляции суперовуляции. Биоптат эндометрия получали на 7–8-й день после пика лютеинизирующего гормона (ЛГ+7–8), диагностированного по мочевому тесту Clear Blue (Unipath Ltd, Великобритания). Все пациентки подписали информированное согласие на проведение исследования.
Для гистологического исследования биоптаты эндометрия фиксировали в 10% нейтральном формалине в течение 24 часов, после соответствующей стандартной обработки заключали в парафин. Срезы толщиной 5 мкн окрашивали гематоксилином и эозином. Исследование гистологических препаратов проводилось в световом микроскопе при увеличении от х50 до х400.
Определение экспрессии мРНК референсных (B2M, GUSB, TBP) и целевых функциональных генов (глютатион пероксидазы 3 GPX3, прогестаген-ассоциированного эндометриального протеина PAEP, дипептидилпептидазы-4 DPP4, трансгелина TAGLN, гиалуронан-связывающего протеина 2 HABP2, инозитолмонофосфатазы 2 IMPA2, аквопорина 3 AQP3, главного комплекса гистосовместимости II класса DO-бета-цепь HLA-DOB, гомеобокса 7 HOX7 или MSX1, периостина POSTN) в биоптатах тканей эндометрия проводилось методом количественной ОТ-ПЦР в режиме реального времени («ДНК-Технология», Россия). Реакцию ставили в двух повторах для каждой точки. Нормировка проводилась по трем референсным генам B2M, TBP и GUSB. Обработка результатов осуществлялась с помощью программы EXСEL на основании данных, полученных с помощью прибора. Использован метод сравнения индикаторных циклов (метод ΔCq). Уровень экспрессии мРНК исследуемых генов измерялся в относительных единицах (о.е.), отражающих представленность транскрипта гена относительно нормировочного фактора, рассчитанного на основе уровня экспрессии мРНК референсных генов.
Во избежание деградации мРНК взятие материала (биоптаты эндометрия) осуществляли в пробирки с раствором гуанидинатиоцианата (лизирующий раствор наборы «Проба НК»). Хранение образцов до завершения программы ЭКО осуществлялось при температуре минус 20°С. Выделение нуклеиновых кислот РНК проводили с использованием набора реагентов «Проба НК» с дополнительными этапами гомогенизации образцов и фенольной депротеинизации.
Результаты исследования транскрипционных профилей проанализированы с помощью кластерного анализа на основе определения евклидовых расстояний. Тепловые карты транскрипционных профилей и кластерный анализ выполнены с использованием системы статистических вычислений R.
При статистической обработке данных в качестве меры центральной тенденции количественных признаков выбрана медиана (Me), а в качестве интервальной оценки – верхний (H) и нижний квартили (L). Для оценки значимости межгрупповых различий применялся U-критерий Манна–Уитни.
Интегральная оценка профилей экспрессии проводилась с помощью метода бинарной логистической регрессии, которые позволили определить классифицирующую дискриминантную функцию вида:
z = a + b1*X1 + b2*Х2+ ...+ bn*Xn, (формула 1), где
z – классифицирующая дискриминантная функция;
а – некоторая константа;
Xi – независимые переменные (уровень экспрессии генов или соотношения экспрессии генов);
bi – коэффициенты.
Использование метода многофакторного анализа позволило произвести разделение (дискриминацию) наблюдений на два класса: пререцептивный и рецептивный эндометрий, восприимчивый к имплантации эмбриона.
На основании значения дискриминантной функции рассчитывался индекс рецептивности эндометрия (ИРЭ). ИРЭ в общем виде может быть представлен как вероятность наличия восприимчивого эндометрия, вычисляется по формуле 2:
р=1/(1+е-z) (формула 2), где
p – вероятность принадлежности наблюдения к определенному классу при полученном значении функции z;
e – основание натурального логарифма.
Для определения оптимального значение величины порога отсечения (точки cut off) использован ROC-анализ (Receiver Operator Characteristic). В основе данного анализа является построение ROC-кривой, которая показывает зависимость количества верно классифицированных положительных образцов от количества неверно классифицированных отрицательных образцов. Критерием выбора точки cut off выбрано требование максимальной суммарной чувствительности и специфичности метода.
Результаты исследования
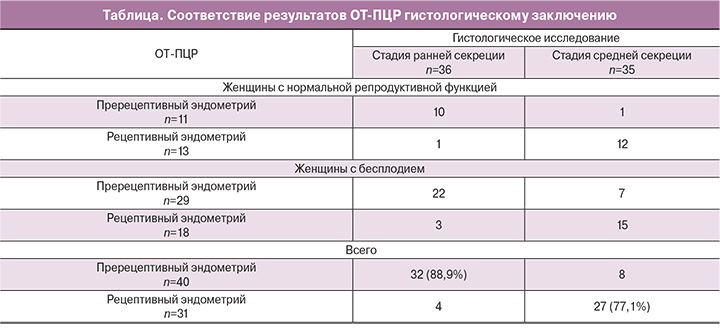
Кластерный анализ результатов исследования транскрипционных профилей 10 генов позволил выделить 2 группы образцов (рис. 1). Разделение на группы хорошо соотносилось, но не во всех случаях совпадало с данными гистологического исследования биоптатов эндометрия (таблица). Из 35 образцов стадии средней секреции согласно данным гистологического исследования, 27 (77,1%) были определены методом ОТ-ПЦР как «рецептивный эндометрий», 8 – как «пререцептивный эндометрий». Из 36 образцов стадии ранней секреции согласно данным гистологического исследования, 32 (88,9%) были определены методом ОТ-ПЦР как «пререцептивный эндометрий», 4 – как «рецептивный эндометрий». Выделения образцов в отдельные кластеры в зависимости от группы обследованных женщин (группа с нормальной репродуктивной функцией или женщины с бесплодием) не наблюдалось.
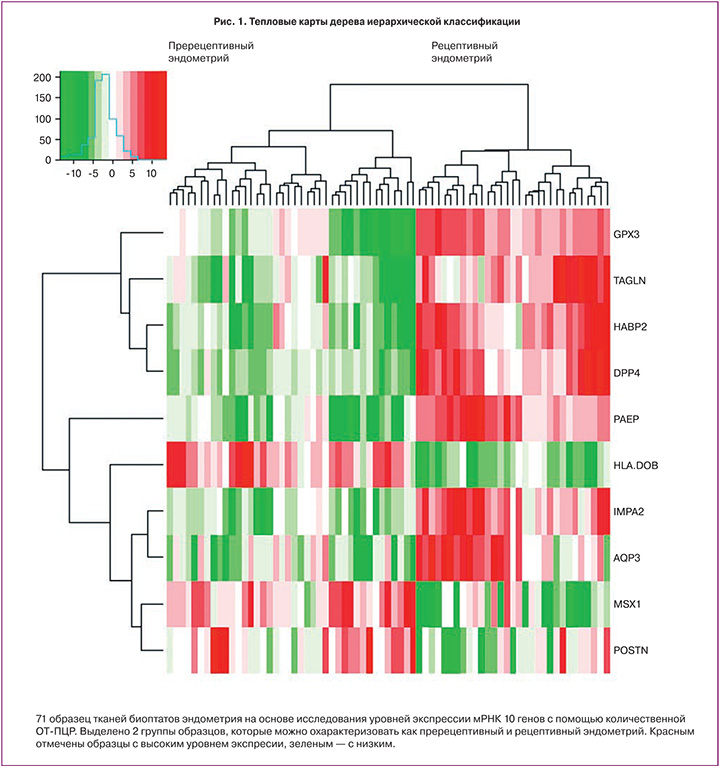
В период «окна имплантации» по сравнению со стадией ранней секреции повышается уровень экспрессии мРНК 7 генов PAEP в 144 раза (53‒663, p=5,8×10-14), GPX3 в 143 (61‒299, p=1,5×10-12), DPP4 в 46 (16‒138, p=1,7×10-12), HABP2 в 26 (14‒54, p=4,0×10-11), AQP3 в 5,9 (1,7‒8,5, p=1,0×10-7), IMPA2 в 4,7 (3,6‒7,8, p=2,5×10-11), TAGLN в 3,3 (2,7‒8,1, p=1,5×10-9) раза, понижается уровень экспрессии мРНК 3 генов HLA-DOB в 17,5 (9,5‒26,5, p=8,2×10-12), MSX1 в 2,8 (1,4‒4,2, p=3,4×10-7), POSTN в 1,6 (0,9‒3,3, p=0,002) раза (рис. 2).
На основе многофакторного анализа подобрана дискриминантная функция, позволяющая классифицировать образцы по уровню экспрессии 4 генов: PAEP, DPP4, MSX1 и HLA-DOB. Уравнение линейной функции имело вид:
z=0,32×ln([PAEP])/([MSX1])+0,37×ln([DPP4])/([HLA-DOB])+0,42, (формула 3), где
z – классифицирующая дискриминантная функция;
([PAEP])/([MSX1]), ([DPP4])/([HLA-DOB]) – соотношение уровней экспрессии мРНК соответствующих генов.
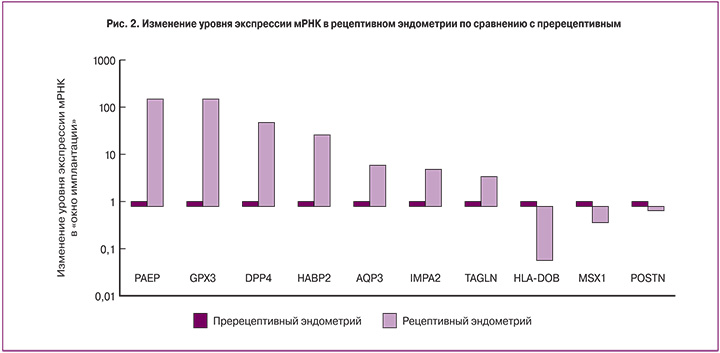
Распределение ИРЭ в образцах пререцептивного и рецептивного эндометрия представлено на рис. 3.
Оптимальное значение величины порога отсечения (точки cut off) определено с помощью ROC-анализа. Площадь под ROC-кривой составила AUC=1,0 (p=6,6×10-13). Пороговое значение (cut off) ИРЭ составило 62. Значение показателей cut off выше 62 классифицирует образцы как «рецептивный эндометрий». Чувствительность и специфичность предложенного метода оценки рецептивности эндометрия в области порогового значения составила 100% по сравнению с кластерным анализом.
Обсуждение
 Большинство задач, стоявших перед специалистами в области репродуктивной медицины с использованием программ ВРТ, были успешно решены, включая контролируемую овариальную стимуляцию, поддержку лютеиновой фазы, технику забора ооцитов, их оплодотворение, культивирование, криоконсервацию и перенос эмбрионов. Впечатляющие результаты достигнуты в области преимплантационных генетических исследований. Преимплантационный генетический скрининг на предмет анеуплоидий и преимплантационная диагностика для выявления заболеваний, полученных от родителей-носителей различных мутаций, стали доступными к рутинному практическому использованию [8]. Однако проблема имплантации при хорошем качестве переносимого эмбриона остается «последним барьером» на пути развития ВРТ [9].
Большинство задач, стоявших перед специалистами в области репродуктивной медицины с использованием программ ВРТ, были успешно решены, включая контролируемую овариальную стимуляцию, поддержку лютеиновой фазы, технику забора ооцитов, их оплодотворение, культивирование, криоконсервацию и перенос эмбрионов. Впечатляющие результаты достигнуты в области преимплантационных генетических исследований. Преимплантационный генетический скрининг на предмет анеуплоидий и преимплантационная диагностика для выявления заболеваний, полученных от родителей-носителей различных мутаций, стали доступными к рутинному практическому использованию [8]. Однако проблема имплантации при хорошем качестве переносимого эмбриона остается «последним барьером» на пути развития ВРТ [9].
Ведущую роль в процессе имплантации играет рецептивность эндометрия – способность обеспечить ориентацию бластоцисты в полости матки, ее адгезию и инвазию. К сожалению, только гистологическое исследование не дает информацию о рецептивности эндометрия. При использовании гистологических методов был предложен ряд маркеров «окна имплантации», таких как наличие пиноподий, уровень экспрессии фактора, ингибирующего лейкемию (ЛИФ), рецепторов к стероидным гормонам и других [10, 11].
Однако быстро развивающиеся новые технологии исследования глобальных профилей генома и продуктов экспрессии генов, таких как микроматричный анализ и секвенирование нового поколения, способствовали быстрому накоплению информации о вариабельности генома и функциональной активности генов. В настоящее время накоплен большой объем информации о маркерах рецептивности эндометрия и транскрипционном профиле генов в разные стадии менструального цикла и при различных физиологических состояниях.
Большинство исследователей изучали транскрипционные сигнатуры (отпечатки или образы распознавания образца по экспрессионному профилю генов) в тотальной ткани эндометрия без ее разделения на отдельные компоненты. A.P. Ponnampalam и соавт. были первыми, кто исследовал транкрипционные профили генов с помощью микроматричного анализа на протяжении всего менструального цикла [12]. Они выделили 425 генов, экспрессия которых повышена не менее чем в 2 раза хотя бы в одной из фаз менструального цикла. Из исследованных нами генов в этот список входят GPX3 и AQP3. На основе анализа этих данных они выделили 7 групп генов, имеющих максимальные уровни экспрессии в одну из стадий менструального цикла: менструация, ранняя пролиферация, средняя пролиферация, поздняя пролиферация, ранняя секреция, средняя секреция, поздняя секреция.
Группа исследователей S. Talbi и соавт. выделили 4 кластера генов с высоким уровнем экспрессии, позволяющих дискриминировать 4 стадии: пролиферация, ранняя, средняя и поздняя секреция [13]. Помимо этого, они описали связь уровня экспрессии этих генов с их функциями и биологическими процессами, характерными для каждой из выделенных стадий цикла. Стадия средней секреции, соответствующая «окну имплантации», характеризуется активацией генов, ответственных за межклеточное взаимодействие, внутриклеточные сигнальные каскады, ионный гомеостаз клеток, метаболизм и синтез аминокислот, органических кислот и полисахаридов, снижение пролиферативной активности клеток, а также клеток, вовлеченных в иммунный ответ и ответ клеток на химические повреждающие вещества, ионы, ранение и стресс.
В отношении рецептивности эндометрия в большинстве исследований глобальных транскрипционных сигнатур стадия «окна имплантации» сравнивается с другими стадиями менструального цикла: стадия средней секреции против пролиферации [14–16], стадия средней секреции против ранней секреции [17–22], рецептивный и пререцептивный эндометрий, то есть ранняя секреция+поздняя пролиферация [11], рецептивный и пострецептивный эндометрий стадии поздней секреции [22, 23]. На основе анализа этих данных выбрано 10 генов, которые были бы информативны для определения стадии «окна имплантации» и реализации цели данного исследования.
Помимо накопления информации об особенностях экспрессионных профилей стадии «окна имплантации» некоторые тесты уже предложены к практическому применению для определения рецептивности эндометрия у женщин, реализующих репродуктивную функцию в программах ЭКО. В качестве примера можно привести тест «Endometrial Receptivity Array (ERA)», представляющий собой микрочип, содержащий 238 генов. Все исследованные нами гены входят в этот список. Тест дает возможность на основании изменения экспрессии данных генов в течение менструального цикла диагностировать персональное «окно имплантации» в эндометрии женщины вне зависимости от данных гистологического исследования. Применение диагностического теста рекомендовано в естественном цикле (ЛГ+7) или цикле с применением заместительной гормональной терапии (на 5-й день назначения прогестерона) [24].
Использование данного чипа позволило повысить частоту имплантации эмбрионов на 10% (42,4% против 33%). У пациенток с тонким эндометрием (6 мм и менее) в 75% случаев рецептивный статус сохранялся. Частота наступления беременности при использовании ERA для этих пациенток составила 66,7% [25].
В ходе проведенного нами исследования выявлено изменение экспрессии всех исследованных генов в стадию «окна имплантации». Получены результаты, полностью идентичные литературным данным [11]. Применение метода кластеризации позволило нам выделить два кластера образцов, дискриминирующих рецептивный и пререцептивный эндометрий. Результаты данной классификации в 83% случаев соответствовали гистологическому заключению, что согласуется с данными литературы. Как полагают, у каждой 5-й женщины в общей популяции и у каждой 4-й женщины с повторными неудачными попытками ЭКО гистологическое заключение не соответствует рецептивному статусу эндометрия [24].
К практическому применению может быть предложена классификация, определенная методом многофакторного анализа, по уровню экспрессии мРНК 4 генов: PAEP, DPP4, MSX1 и HLA-DOB. Уровень экспрессии двух из них значительно повышен (PAEP, DPP4), а уровень экспрессии двух других (MSX1 и HLA-DOB) снижен в рецептивном эндометрии по сравнению с пререцептивным.
Ген PAEP (progestagen associated endometrial protein), также известный как ассоциированный с беременностью эндометриальный α2-глобулин (PAEG) или плацентарный протеин 14 (PP14), кодирует гликопротеин суперсемейства липокалинов, гены большинства из которых сгруппированы на длинном плече хромосомы 9. PAEP имеет три изоформы, которые играют важную роль в поддержании внутриматочной среды, пригодной для обеспечения, инициации и элонгации беременности. Помимо эндометрия и амниотической жидкости высокая экспрессия данного гликопротеина обнаружена в фолликулярной жидкости и семенной плазме, где его функции связывают с обеспечением последовательности событий, необходимых для оплодотворения [26].
Ген DPP4 (dipeptidyl peptidase 4), также известный как кластер дифференцировки СD26, кодирует дипептидилпептидазу-4, которая представляет собой мембранный фермент, гидролизирующий пептидную связь с N-конца пролина. Продукт гена является поверхностным антигеном активации Т-клеток СD26, экспрессирован на поверхности большинства клеток организма, участвует в иммунной регуляции, переносе сигнала, гомеостазе глюкозы и в апоптозе [27].
Ген MSX1 (msh homeobox 1) или ген гомеобокса 7 HOX7 кодирует белок семейства гомеобокса. В результате взаимодействия с компонентами комплексов транскрипции данный протеин обеспечивает репрессию генов дифференцировки во время эмбриогенеза, играет роль в подавлении роста тканей [28].
Ген HLA-DOB (major histocompatibility complex, class II, DO beta) кодирует β-цепь белка, выполняющего вспомогательную функцию в презентации антигенов. Белок HLA-DO, взаимодействуя с HLA-DМ, подавляет пептидную загрузку молекул главного комплекса гистосовместимости II класса, препятствуя презентации антигенов [29].
Мы полагаем, что предлагаемая нами модель может быть использована для классификации пререцептивного и рецептивного эндометрия в естественных циклах ЭКО (ЛГ+7) или в циклах с применением заместительной гормональной терапии (на 5-й день назначения прогестерона), однако она требует дальнейшей валидации на большем количестве образцов. Помимо этого, актуальным остается вопрос определения пострецептивного статуса эндометрия. Среди исследованных нами образцов «пострецептивного» эндометрия не было. Молекулярная классификация трех функциональных состояний эндометрия (пререциптивный, рецептивный и пострецептивный) значительно оптимизировала бы предимплантационную диагностику эндометрия и ускорила процесс определения персонального «окна имплантации».
C широким внедрением в практику программ ВРТ методов предимплантационного генетического скрининга и криоконсервации эмбрионов все большая часть переноса эмбрионов будет осуществляться в естественных менструальных циклах при сохраненной овуляции и в циклах заместительной гормональной терапии при ее отсутствии, поэтому задача определения персонального «окна имплантации» будет все более востребованной и актуальной.
Заключение
В результате исследования транскрипционных профилей генов GPX3, PAEP, DPP4, TAGLN, HABP2, IMPA2, AQP3, HLA-DOB, MSX1 и POSTN установлены достоверные различия в уровне экспрессии мРНК этих генов в пререцептивном и рецептивном эндометрии, что позволило классифицировать образцы в соответствии с их рецептивным статусом. Предложена модель определения персонального «окна имплантации», которая в дальнейшем может быть апробирована и использована в программах ВРТ.



