Несмотря на значительные достижения в области вспомогательных репродуктивных технологий (ВРТ), существенному проценту супружеских пар, прибегающим к ВРТ, не удается достичь наступления беременности после повторных попыток экстракорпорального оплодотворения (ЭКО). Повторные неудачи имплантации – неспособность достижения клинической беременности после переноса по крайней мере четырех эмбрионов хорошего качества, как минимум в трех лечебных циклах ЭКО или криопротоколах у женщин в возрасте до 40 лет [1].
Повторные неудачи имплантации – серьезная проблема, решению которой посвящено большое количество как клинических, так и фундаментальных исследований в области репродукции человека.
Наименее изученными являются иммунологические аспекты неудач имплантации. Несмотря на единичные данные о повышении соотношения Th1/Th2 и снижении супрессивной способности Т-регуляторных (Трег) клеток в периферической крови у пациенток с повторными неудачами имплантации, не изучены особенности субпопуляционного состава лимфоцитов периферической крови у этих женщин [2].
Среди лимфоцитов наиболее значимыми для реализации репродуктивной функции, а следовательно, для наступления беременности считаются субпопуляции с цитотоксической функцией, а именно: большие гранулярные лимфоциты с естественной киллерной активностью (NК-клетки) и фенотипом CD56+, CD16+, лимфоциты с цитотоксической функцией CD3-CD8+, которые также, как и киллерные клетки, являются представителями врожденного иммунитета, и лимфоциты с фенотипом CD3+CD8+, появляющиеся в результате активации реакций адаптивного иммунитета. Несмотря на большое количество исследований по оценке лимфоцитов указанных субпопуляций в репродукции, роль их для наступления и пролонгирования беременности остается невыясненной [1].
Большое значение для формирования механизмов толерантности к аллоантигенам плода в процессах наступления и развития беременности принадлежит Т-лимфоцитам с фенотипом CD4+CD25+ и внутриклеточной экспрессией фактора Foхр3+ – клеткам с естественной регуляторной функцией, или Т-регуляторным клеткам (Трег), а также γδ-Т-клеткам [2, 3]. Важной особенностью γδ-Т-клеток является способность регулировать работу Tрег путем взаимодействия с их рецепторами к интерферону. Было показано, с одной стороны, что γδ-Т-клетки, несущие маркер NK-клеток (СD56+/ТCRγδ+), продуцируют цитокины Th1-типа (провоспалительные), с другой, что они имеют прогестероновые рецепторы и вырабатывают прогестерон-индуцированный блокирующий фактор (ПИБФ), что способствует переключению Th1-типа иммунного ответа на Th2-тип, необходимый для успешной имплантации [4].
В настоящее время отсутствует единая точка зрения на целесообразность проведения иммунологических исследований и назначения различных видов иммунотерапии у женщин с повторными неудачами имплантации.
Целью настоящей работы стало исследование в периферической крови содержания субпопуляций лимфоцитов с цитотоксической, киллерной и регуляторной функцией у пациенток с повторными неудачами имплантации в программах ВРТ.
Материал и методы исследования
В исследование были включены 74 женщины. Основную группу (группу 1) составили 48 пациенток с повторными неудачами имплантации в программе ЭКО. Группу сравнения (группу 2) – 26 фертильных рожавших женщин без соматических заболеваний с неотягощенным акушерским анамнезом в возрасте от 24 до 40 лет, имеющих последнего ребенка не старше 2 лет. Основная группа была разделена на 2 подгруппы в зависимости от вида ВРТ: 1а (n=29) – пациентки, которым проводилась стимуляция суперовуляции в протоколе с антагонистом гонадотропин-рилизинг гормона, группа 1б (n=19) – пациентки, которым проводился криоцикл.
Критериями включения в основную группу (группу 1) были: возраст пациенток до 37 лет включительно, неудачные попытки ЭКО как минимум в 3 свежих циклах стимуляции суперовуляции или криоциклах, перенос эмбрионов хорошего качества в неудачных программах ЭКО и криоциклах.
Критериями исключения в основной группе (группу 1) были: наличие системных аутоиммунных заболеваний, мужской фактор (выраженная патозооспермия), патология матки: врожденные аномалии матки, внутриматочные синехии, интерстициальная или субсерозная миома матки более 4 см, полипы эндометрия, наружный генитальный эндометриоз III–IV стадии; «тонкий» эндометрий (М-эхо≤8 мм), гидросальпинкс и/или тубоовариальное образование с одной или обоих сторон, синдром поликистозных яичников, «бедный ответ» яичников на гонадотропную стимуляцию, хромосомные аномалии супругов.
Пациентам проводили полное клинико-лабораторное обследование в соответствии с Приказом МЗ РФ от 30 августа 2012 г. № 107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению».
Программу ЭКО проводили в протоколе с антагонистом гонадотропин-рилизинг гормона: со 2–3-го дня менструального цикла начинали стимуляцию суперовуляции препаратами рекомбинантного ФСГ или человеческого менопаузального гонадотропина. В качестве триггера овуляции использовали препарат человеческого хорионического гонадотропина в дозе 10 000 МЕ за 35–36 часов до проведения трансвагинальной пункции. Перенос эмбрионов в полость матки выполняли на 3-и или 5-е сутки после трансвагинальной пункции. В посттрансферном периоде проводили поддержку препаратами микронизированного прогестерона в дозе 600 мг/сутки.
Подготовку эндометрия в криоциклах осуществляли с использованием заместительной гормональной терапии препаратами эстрогенов и прогестерона под ультразвуковым контролем. На 6-е сутки после начала приема прогестерона выполняли перенос размороженного эмбриона в полость матки под ультразвуковым контролем.
Кровь для анализа в контрольной группе забирали натощак из локтевой вены на 18–22-й день менструального цикла, у пациенток в стимулированном цикле – в день трансвагинальной пункции, а у пациенток в криоцикле – в день начала приема препаратов микронизированного прогестерона.
Поверхностный фенотип клеток периферической крови определяли с помощью стандартного набора моноклональных антител (мАт), меченных флуоресцеин-изотиоцианатом (ФИТЦ) или фикоэритрином (ФЭ), против антигенов CD3(ФИТЦ), CD8(ФЭ), CD16(ФЭ), CD56(ФЭ), CD56(ФИТЦ), gdТКР(ФЭ) (Becton Dickinson и eBioscience, США). Оценивали содержание регуляторных gd+Т-лимфоцитов, а также содержание субпопуляции естественных Трег как субпопуляцию с фенотипом СD4+CD25highCD127low/- [5]. Лимфоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью мАт к СD45, меченных перидинин-хлорофилл протеином (Per-CP) (Dako, Дания). Для оценки позитивно-окрашенных субпопуляций использовали соответствующие ФИТЦ или ФЭ-меченые изотипические IgG. Для оценки процентного содержания Трег использовали набор, содержащий моноклональные антитела к антигенам CD4, меченые Per-CP (eBioscience, США), CD25, меченые ФИТЦ (Becton Dickinson, США) и СD127, меченые ФЭ (eBioscience, США). Оценивали долю Трег среди CD4+-клеток. Моноклональные антитела добавляли непосредственно к цельной крови, затем лизировали с помощью раствора FACS Lysing Solution (Becton Dickinson, США). Анализ проводили на проточном цитофлуориметре FACSСalibur (Becton Dickinson, США) с использованием программы CellQuest.
Статистическую обработку данных производили общепринятыми методами вариационной статистики. Данные представлены как среднее ± ошибка среднего. Соответствие расчетных выборок показателей нормальному распределению оценивали с помощью критерия Шапиро–Уилка с использованием пакета MedCalc12 для Windows 7. Значимость наблюдаемых отклонений средних значений измеренных параметров оценивали с помощью двухвыборочного t-критерия Стьюдента с различными дисперсиями для средних значений с использованием пакета статистического анализа для Microsoft Office Excel 2007. Для оценки диагностической значимости тестов фенотипирования лимфоцитов периферической крови женщин с бесплодием использовали ROC-анализ пакета MedCalc12 для Windows 7.
Результаты исследования
Результаты сравнительной оценки содержания лимфоцитов с цитотоксической функцией и фенотипом CD8+, NK-клеток с фенотипом CD56,16+, естественных Трег и gd+Т-клеток у пациенток обеих групп представлены в табл. 1.
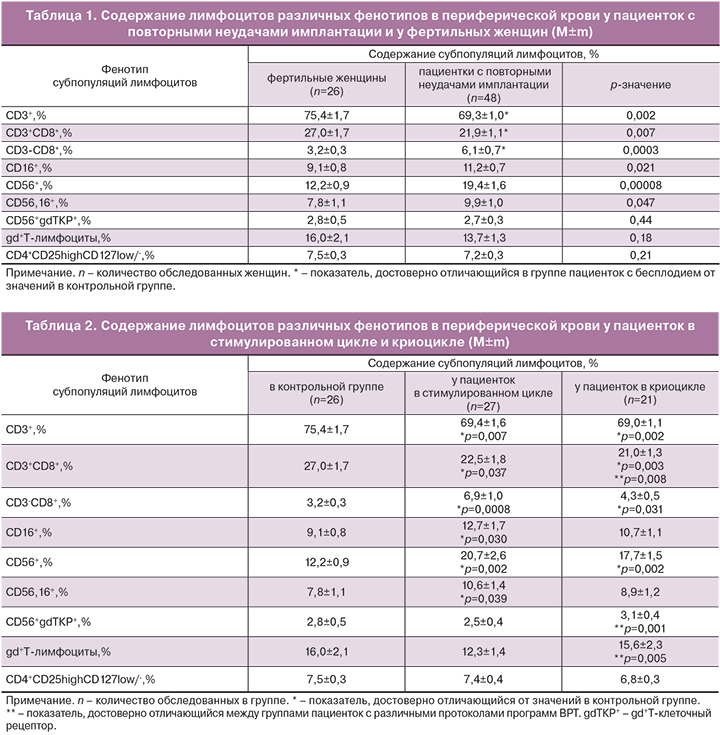
Обращает на себя внимание, что у пациенток повторными неудачами имплантации снижено общее содержание Т‑лимфоцитов (CD3+‑клеток) и Т‑лимфоцитов с цитотоксической функцией (CD3+CD8+), увеличено содержание клеток врожденного иммунитета как с цитотоксической (CD3-CD8++), так и с киллерной функцией (CD56+, CD16+, CD56,16+), но отсутствовали различия в содержании естественных регуляторных клеток и регуляторных gd+Т-лимфоцитов по сравнению с контрольной группой.
В связи с рандомизацией анализ субпопуляционного состава лимфоцитов был также проведен в двух подгруппах пациенток с бесплодием, выделенных по типу программы ВРТ (подгруппа 1а-стимулированный цикл, подгруппа 1б-криоцикл). Результаты представлены в табл. 2.
Из данных табл. 2 следует, что в подгруппе пациенток в стимулированном цикле повторились особенности субпопуляционного состава, выявленные при анализе общей выборки пациенток с повторными неудачами имплантации (сниженное содержание Т-лимфоцитов, увеличенное содержание лимфоцитов с цитотоксической и киллерной функцией, равное содержание Tрег клеток). В подгруппе пациенток в криоцикле снижено общее содержание CD8+-лимфоцитов, увеличено содержания gd+Т-лимфоцитов в сравнении с аналогичными показателями, как в контрольной группе, так и в подгруппе у пациенток в стимулированном цикле. Установлено, что содержание CD16+-и CD56,16+-лимфоцитов не отличается от контрольной группы. Содержание клеток с естественной киллерной активностью, экспрессирующих на своей поверхности gd+Т-клеточный рецептор, увеличено по сравнению с аналогичным показателем у пациенток в стимулированном цикле, но не у пациенток в контрольной группе.
В целом, значимых отличий в уровне Tрег-клеток в исследуемой группе по сравнению с контрольной группой не было выявлено.
Обсуждение
К настоящему времени в области репродуктивной иммунологии достигнуты значительные успехи, свидетельствующие о том, что нормальное осуществление репродуктивной функции возможно благодаря наличию уникальных врожденных и приобретенных иммунологических механизмов [3].
Сложный процесс имплантации эмбриона включает в себя скоординированные во времени и пространстве эффекты многочисленных эндокринных и иммунных факторов. Имеются существенные доказательства, что нарушение экспрессии неклассических молекул HLA, дисбаланс цитокинов, а также изменение в количестве и активности NK-клеток вносят свой вклад в нарушения репродуктивной функции.
В данной работе оценивались особенности субпопуляционного состава лимфоцитов периферической крови с цитотоксической, киллерной и регуляторной функцией у женщин с повторными неудачами имплантации в программах ВРТ.
Установлено, что увеличение содержания клеток с киллерной и цитотоксической активностью наблюдалось в обеих группах пациенток по сравнению с контрольной группой. Но в отличие от группы женщин в стимулированном цикле ВРТ, в группе пациенток с криоциклом содержание клеток с фенотипом CD56,16+ не отличалось от аналогичных показателей в контрольной группе. При одинаковом превышении содержания CD3-CD8+ клеток в группе женщин с повторными неудачами имплантации в программе ВРТ, по сравнению с контрольной группой, в группе пациенток в криоцикле отмечено снижение содержания CD3+CD8+ по сравнению с аналогичным показателем как в группе фертильных женщин, так и в группе пациенток в стимулированном цикле. При одинаковом превышении содержания клеток с фенотипом CD56+ в обеих подгруппах основной группы, по сравнению с контрольной группой, в группе пациенток в криоцикле отмечается более высокий уровень CD56+gdТКР+-клеток, чем в группе пациенток в стимулированном цикле, что может отражать разное состояние иммунной системы пациенток в стимулированном цикле и криоцикле.
Известно, что Трег являются важной составляющей в регулировании воспалительного иммунного ответа [4]. Фенотипически эти клетки определяются как CD4+CD25+Foxp3+. [5] Они способны осуществлять контроль толерантности к собственным антигенам и регулировать аутоиммунитет [6]. Эти клетки влияют на фертильность, что доказывается их увеличением в лимфатических узлах мышей за 2 дня до оплодотворения [7]. Это раннее увеличение Трег в лимфатических узлах сопровождается накоплением FOXP3+клеток и повышением экспрессии мРНК FoxP3 в эндометрии. Действительно, в эндометрии число Трег увеличивается до овуляции и уменьшается во время лютеиновой фазы [8]. Кроме того, в периферической крови Tрег увеличивались в период овуляции, указывая на их ключевую роль в периовуляторный период менструального цикла [8]. У женщин с повторными неудачами имплантации отмечается в том числе увеличение продукции цитокинов Th1-направленности по сравнению с конт-рольной группой женщин репродуктивного возраста. Эта разница в продукции цитокинов отчасти является результатом снижения супрессирующей способности Tрег [9].
Большой интерес вызывают gd+Т-клетки, проявляющие регуляторные функции и играющие существенную роль в физиологии репродукции [10]. gd+Т-клетки действуют как клетки врожденного иммунитета и напрямую распознают белковые и небелковые фосфолиганды без участия молекул главного комплекса гистосовместимости [11]. Известно, что gd+Т-клетки способны регулировать работу Tрег путем взаимодействия с их рецепторами к интерферону [12]. Было показано, с одной стороны, что γδ-Т-клетки, несущие маркер NK-клеток (СD56+ТCRγδ+), продуцируют цитокины Th1-типа (провоспалительные), с другой, что они имеют прогестероновые рецепторы и вырабатывают ПИБФ, что способствует переключению Th1-типа иммунного ответа на Th2-тип, необходимого для успешной имплантации [4].
Известно, что любое гормональное воздействие приводит к изменению состояния иммунного статуса женщин [13]. Есть данные о влиянии эстрогенов на уровень Tрег клеток и о прямой зависимости концентрации Tрег клеток от уровня эстрадиола в периферической крови у пациенток с повторными неудачами имплантации [14].
В нашей работе показано, что значимых отличий в уровне Tрег клеток в группе пациенток в стимулированном цикле и криоцикле от аналогичного показателя в контрольной группе пациенток нет. Однако у пациенток в криоцикле отмечен более высокий уровень gd+Т-клеток, что связано, вероятно, с воздействием препаратов эстрогенов, используемых для подготовки эндометрия у пациенток в криоцикле.
Учитывая, что периферическую кровь для анализа иммунного статуса забирали на фоне гонадотропной стимуляции или приема препаратов эстрогенов, возникает необходимость оценки иммунного статуса пациенток вне протокола для понимания динамики субпопуляционного состава лимфоцитов периферической крови, в том числе Tрег клеток, у пациенток с повторными неудачами имплантации в ходе протокола.
Заключение
Таким образом, особенностями субпопуляционного состава лимфоцитов у пациенток с повторными неудачами имплантации являются общее снижение содержания Т-лимфоцитов (CD3+-клеток) и Т-лимфоцитов с цитотоксической функцией (CD3+CD8+), увеличение содержания клеток врожденного иммунитета как с цитотоксической функцией (CD3-CD8+), так и с киллерной функцией (CD56+, CD16+, CD56,16+). Это является основанием для проведения коррекции иммунологических нарушений, что позволит оптимизировать диалог между перенесенным эмбрионом и иммунной системой матери. Также показано, что значимых отличий в уровне Tрег клеток у пациенток с повторными неудачами имплантации по сравнению с фертильными женщинами нет, однако у группы пациенток в криоцикле отмечено достоверное увеличение содержания gd+Т-клеток, что требует проведения дальнейших исследований оценки иммунного статуса пациенток вне протокола для понимания динамики субпопуляционного состава лимфоцитов периферической крови.



