Проблема преждевременных родов (ПР) и внутриутробного инфицирования плода (ВУИ) в современном акушерстве продолжает оставаться актуальной и нерешенной [1–4].
На долю недоношенных детей приходится 60–70% ранней неонатальной смертности и 65–75% детской смертности. Мертворождаемость при ПР в 8–13 раз выше, чем при своевременных родах, а перинатальная смертность у недоношенных новорожденных в 33 раза выше, чем у доношенных [5, 6]. Следует отметить, что 40% ПР обусловлено инфекционными факторами, а ПР до 30 недель беременности имеют инфекционную этиологию в 80% случаев [7–10].
Несмотря на многочисленные научные и практические исследования в этой области, частота ПР не снижается, а в некоторых странах даже растет 11–13].
По современным представлениям, одной из причин развития ПР являются ограниченные возможности иммунной системы беременной своевременно распознавать и уничтожать инфекционные агенты. Это связано со смещением иммунного равновесия в организме беременной в сторону преобладания врожденного иммунитета над приобретенным [14–16].
Система цитокинов играет важную роль в течение всей беременности, регулируя процессы инвазии трофобласта, межклеточные взаимоотношения в эндометрии, воспалительные реакции [17]. При осложненном течении беременности на фоне урогенитальной инфекции (УГИ) отмечается увеличение в периферической крови провоспалительных цитокинов, что приводит к возрастанию продукции простагландинов и ферментов, способствующих сокращениям матки и раскрытию шейки матки [18, 19].
 Дальнейшие исследования в этой области и поиск новых иммунологических маркеров невынашивания беременности позволят выявить пациенток групп риска по развитию ПР, своевременно проводить патогенетически обоснованную терапию с целью улучшения исходов беременности и родов, снижения перинатальной заболеваемости и смертности.
Дальнейшие исследования в этой области и поиск новых иммунологических маркеров невынашивания беременности позволят выявить пациенток групп риска по развитию ПР, своевременно проводить патогенетически обоснованную терапию с целью улучшения исходов беременности и родов, снижения перинатальной заболеваемости и смертности.
Целью нашего исследования стало определение диагностической и прогностической значимости комплексного исследования интерферонового статуса у беременных высокого инфекционного риска.
Материал и методы исследования
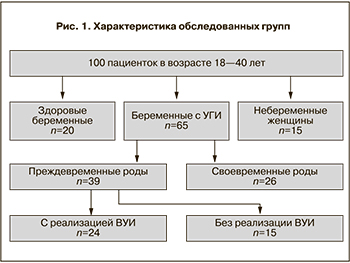
Нами проведено клинико-лабораторное обследование 100 пациенток и их новорожденных. Все пациентки были разделены на три группы. В I основную группу) вошли 65 беременных с наличием УГИ. Критериями включения пациенток в основную группу являлись: срок беременности от 25 до 32 недель, наличие УГИ, угроза ПР. Критериями исключения пациенток из основной группы являлись: многоплодная беременность, острые инфекционные, воспалительные заболевания, оперативное родоразрешение.
Основная группа проспективно в зависимости от исхода беременности была разделена на 3 подгруппы: Iа подгруппа – 24 беременные с ПР и реализацией ВУИ; Iб подгруппа – 15 беременных с ПР без реализации ВУИ и Iв подгруппа – 26 беременных со своевременными родами. Во II контрольную группу) вошли 20 пациенток без УГИ, у которых беременность завершилась своевременными родами. В III (группу сравнения) вошли 15 небеременных женщин (рис. ).
В обследованных группах изучали: данные соматического и акушерского анамнеза, течение настоящей беременности, особенности родового акта, состояние новорожденных. Всем пациенткам проводили комплексное клинико-лабораторное обследование (клинический анализ крови и мочи, определение группы крови и резус-фактора, биохимический анализ крови, гемостазиограмма, анализ микрофлоры влагалища и цервикального канала).
Определение экспрессии генов цитокинов в мононуклеарных клетках периферической крови пациенток проводили с использованием метода обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР) [20].
Выделение РНК проводили по методике P. homczynski, N. Sacchi, [21] методом кислой гуанидин-тиоцианат-фенол-хлороформ экстракции. ОТ-ПЦР – амплификация были выполнены в соответствии с методикой, предложенной С.М. elder, P.S. Thomas [22]. В работе были использованы пары праймеров, последовательность которых получена из базы данных «PrimerBank»: интерферон (ИФН)-α [22], ИФН-γ 23], в качестве положительного контроля использовали β-актин [24]. Регистрацию результатов ПЦР осуществляли электрофоретически в 2,5% агарозном геле, окрашенным бромистым этидием. Для идентификации нуклеотидных последовательностей использовали маркер для электрофореза фирмы Promega (G 1758).
Определение выработки интерферонов и чувствительности лейкоцитов периферической крови (ЛПК) к препаратам интерферонов проводили биологическим методом. Для осуществления данного метода у обследуемых получали 1 мл венозной крови в пробирку с гепарином 25 ЕД/мл путем пункции локтевой вены. Далее индивидуально определяли способность к продукции ИФНα и ИФНγ ЛПК биологическим методом тестирования интерферонов. В этом случае в ответ на обработку ЛПК субоптимальными дозами митогенов у одних индивидуумов происходит значительное увеличение индуцируемой продукции ИФН, у других – нет. В качестве митогена для стимуляции выработки ИФН-α использовали вирус болезни Ньюкасла (ВБН), для индуцирования ИФН-α – фитогемагглютинин (ФГА).
Определение продукции ИФН проводили в трех лунках для каждого препарата (ВБН, ФГА, ВБН+ИФН-α, ФГА+ИФН-γ) в 96-луночных круглодонных планшетах, в которые вносили по 20 мкл цельной крови (независимо от формулы крови) в 160 мкл среды (разведенную в 10 раз) RPMI-1640 (ПанЭко, Москва), содержащая 2 мкМ L-глутамина, 50 мкМ 2-меркаптоэтанола (Serva, США), 160 мкг/мл гентамицина, 10 млМ HERES буфера, 10% инактифированной ТЭС. В определенной последовательности вносили среду RPMI-1640 c 10–20 МЕ/мл препарата ИФН-α либо ИФН-γ, затем – ВБН в дозе 4-6 lg ТЦИД50 (тканевая цитопатическая доза) для определения титров ИФН-α и митоген – ФГА в дозе 5 мкг/мл для определения титров ИФН-γ. Планшеты инкубировали 24 часа в СО2-инкубаторе при 37°С. Затем биологическим методом определяли активность интерферонов в каждой пробе.
Определение активности интерферонов в культурах лейкоцитов проводили в 96-луночных плоскодонных планшетах с культурой диплоидных фибробластов человека, выращенных в ростовой среде до образования монослоя. В качестве индикаторного тест -вируса использовали вирус энцефаломиокардита мышей. За единицу активности ИФН (Ед/мл) принимали величину, обратную его максимальному разведению, которая защищала 50% клеток от цитопатического действия 100 ТЦИД50 вируса. В каждом титровании использовался также референс-препарат ИФН для перевода полученной активности ИФН в международные единицы (МЕ) [25, 26].
Определение чувствительности ЛПК к препаратам интерферонов осуществляли, используя предварительную обработку (примирование) клеток препаратами ИФН-α и ИФН-γ с последующей оценкой индуцированной выработки интерферонов.
Пациентку считали чувствительной к препаратам ИФН-α и ИФН-γ, если ее ЛПК отвечали увеличением продукции интерферонов при примировании хотя бы одним из препаратов интерферонов (реаферон, реальдирон, интрон А, роферон А, гаммаферон) [20]. Статистическую обработку данных производили с использованием статистического пакета программ Statistica 7 и MS Office Exсel 2010 с применением методов параметрической и непараметрической статистики. Учитывая малый объем выборки и неправильное распределение показателей, достоверность различия между группами определяли с помощью критерия Манна–Уитни. Различия между сравниваемыми величинами признавали статистически достоверными при уровне значимости р<0,05.
Результаты исследования и обсуждение
В ходе клинического изучения анамнеза в обследованных группах нами не было выявлено достоверных различий по массо-ростовым показателям, наследственности, особенностям менструальной функции.
Возраст обследованных пациенток варьировал от 18 до 40 лет, средний возраст составил 29,0±4,5 года. Однако в основной группе у беременных с ПР возраст пациенток свыше 35 лет выявлен достоверно чаще, чем в контрольной группе (30,8 и 10,0% соответственно; р<0,05), что подтверждает наличие взаимосвязи ПР и возраста.
При изучении общего соматического анамнеза у пациенток с ПР отмечена высокая частота хронических заболеваний: хронический пиелонефрит (45,8% – в Iа подгруппе, 46,7% – в Iб подгруппе, 10,0% – в группе контроля), хронический тонзиллит (16,7 и 13,3% соответственно по сравнению с группой контроля – 5,0%) и эндокринные заболевания (25,0 и 26,7% соответственно по сравнению с группой контроля – 10,0%; р<0,05).
 В структуре гинекологической патологии с высокой частотой были выявлены: хронический сальпингоофорит (в Iа подгруппе – 54,2%, в Iб подгруппе – 46,7%, в группе контроля – 10,0%), кольпиты различной этиологии (33,3% – в Iа подгруппе, 40,0% – в Iб подгруппе, тогда как в контрольной группе кольпит выявлен у 15,0%), эктопия шейки матки (45,8, 53,3, 10,0% соответственно; р<0,05), данный факт свидетельствует о нарушении местных иммунных механизмов у пациенток с ПР. При изучении акушерского анамнеза в группе беременных с ПР отмечена высокая частота самопроизвольных и медицинских абортов в анамнезе (35,4% по сравнению со здоровыми беременными – 15,0%; p<0,05), что могло способствовать развитию хронического воспалительного процесса.
В структуре гинекологической патологии с высокой частотой были выявлены: хронический сальпингоофорит (в Iа подгруппе – 54,2%, в Iб подгруппе – 46,7%, в группе контроля – 10,0%), кольпиты различной этиологии (33,3% – в Iа подгруппе, 40,0% – в Iб подгруппе, тогда как в контрольной группе кольпит выявлен у 15,0%), эктопия шейки матки (45,8, 53,3, 10,0% соответственно; р<0,05), данный факт свидетельствует о нарушении местных иммунных механизмов у пациенток с ПР. При изучении акушерского анамнеза в группе беременных с ПР отмечена высокая частота самопроизвольных и медицинских абортов в анамнезе (35,4% по сравнению со здоровыми беременными – 15,0%; p<0,05), что могло способствовать развитию хронического воспалительного процесса.
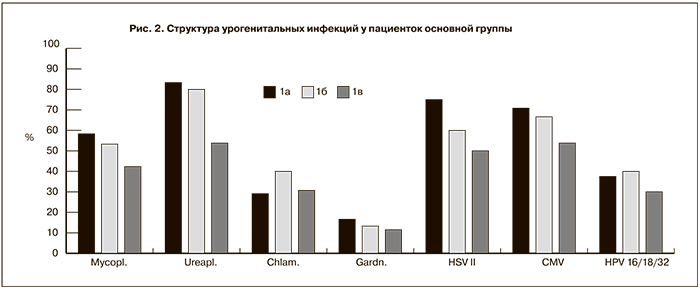
У всех обследованных беременных основной группы отмечалась смешанная вирусно-бактериальная инфекция. В структуре УГИ у пациенток основной группы с наибольшей частотой выявлялась Ureaplasma urealyticum – 83,3% в Iа подгруппе, 80,0% – в Iб подгруппе, тогда как в Iв подгруппе 53,8%. Частота выявления Mycoplasma hominis составила 58,3% в Iа подгруппе, 53,3% – в Iб подгруппе, 42,3% – в Iв подгруппе. Вирус простого герпеса II и цитомегаловирус у беременных с ПР встречались примерно с одинаковой частотой 61,5% и 63,1% соответственно (рис. 2).
С большой частотой в группе ПР регистрировали вагинальный кандидоз (41,0% случаев), что в 2,7 раза выше, чем в группе контроля (15,0%). Бактериальный вагиноз встречался у беременных с ПР – 20,8% в Iа подгруппе и 13,3% в – Iб подгруппе, тогда как в Iв подгруппе бактериальный вагиноз не был выявлен.
При бактериологическом исследовании отделяемого цервикального канала у обследованных пациенток основной группы наиболее часто встречались возбудители: Escherichia coli, Enterococcus faecalis, Staphylococcus aureus, Klebsiella – 29,2% в Iа подгруппе, 26,7% – в Iб подгруппе и 15,4% – в Iв подгруппе, тогда как в группе контроля и сравнения роста микрофлоры не было выявлено.
Частым осложнением беременности у обследованных пациенток основной группы было несвоевременное излитие околоплодных вод – у 70,8% беременных с ПР инфекционного генеза с реализацией ВУИ, у 60,0% беременных с ПР инфекционного генеза без реализации ВУИ и у 27,0% беременных Iв подгруппы, тогда как в контрольной группе данное осложнение беременности наблюдалось только у 15,0% пациенток. Клинические симптомы хориоамнионита наблюдались у 16,7% беременных Iа группы.
В основной группе у 39 беременных родились 39 недоношенных детей. Из них у 24 (61,5%) выявлены различные признаки ВУИ. У 70,8% новорожденных Iа подгруппы выявлена внутриутробная пневмония, у 16,7% – энтероколит, у 11,5% – генерализованная инфекция.
Анализ интерферонового статуса у беременных обследованных групп
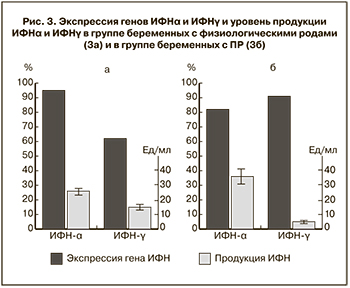
Способность к индуцированной продукции ИФН-α в культуре лейкоцитов беременных с ПР была выше (рис. 3а и 3б), чем у здоровых беременных (35,5±11,6 Ед/мл по сравнению с 25,5±5,4 Ед/мл). Способность к продукции ИФН-γ у беременных с ПР, напротив, была понижена (5,1±2,4 Ед/мл и 14,9±1,6 Ед/мл, соответственно; р<0,05). Таким образом, у беременных, родивших преждевременно, соотношение индуцированной продукции ИФН-α и γ в среднем составило 9,7±3,2, по сравнению с 3,2±1,4 у родивших в срок, р<0,05 по критерию Манна–Уитни. Соотношения индуцированной продукции ИФН-α и γ более 5 может являться прогностическим факторов в отношении ПР и ВУИ плода. Положительная прогностическая ценность этого фактора составляет 69%, отрицательная прогностическая ценность – 85,7%, чувствительность- 90%, специфичность 60%.
При сопоставлении результатов экспрессии генов интерферонов с их продукцией в культуре лейкоцитов показано, что у беременных с ПР высокий уровень экспрессии гена ИФН-α (82,3%) сочетается с высокой выработкой ИФН-α в культуре лейкоцитов (35,5±11,6 Ед/мл), однако на фоне высокого уровня экспрессии гена ИФН-γ (91,0%) продукция его снижена (5,1±2,4 Ед/мл) (рис. 3а и 3б), что свидетельствует о нарушении синтеза ИФН-γ.
Таким образом, выявлен дисбаланс в системе интерфероногенеза при ПР, который проявляется увеличением экспрессии гена ИФН-γ в мононуклеарных клетках и снижением индуцированной продукции интерферонов лейкоцитами периферической крови. Увеличение индуцированной выработки лейкоцитами периферической крови ИФН-α в 5 и более раз по сравнению с выработкой ИФН-γ у беременных с наличием УГИ может наряду с другими показателями иммунитета, в частности, уровнем экспрессии генов TLR (Toll-подобных рецепторов), HBD (противомикробных пептидов) прогнозировать ПР с определенной долей вероятности [9, 16]. По данному способу диагностики нами было получено авторское свидетельство №2486519 «Способ прогнозирования преждевременных родов и внутриутробного инфицирования плода» (2013).
Анализ результатов определения чувствительности ЛПК к препаратам ИФН-α и ИФН-γ
В данной работе нами было проведено in vitro индивидуальное определение чувствительности ЛПК к препаратам ИФН-α (реаферон, реальдирон, интрон А, роферон А) и ИФН-γ (гаммаферон) во всех обследованных группах (таблица).
Следует отметить высокую чувствительность ЛПК у беременных с ПР инфекционного генеза к препаратам ИФНα: роферону А – в 82,0% и интрону А – в 82,0% наблюдений, при этом чувствительность в культуре лейкоцитов к препарату гаммаферону выявлена только в 20,5% случаев; р<0,05.

Таким образом, мы показали, что у пациенток с ПР не только снижена продукция ИФН-γ на посттранскрипционном уровне, но и понижена чувствительность ЛПК к препарату ИФН-γ – гаммаферону, что необходимо учитывать при назначении препаратов интерферона. Полученные нами данные являются основанием для проведения более масштабных исследований, которые позволили бы определить целесообразность назначения препаратов интерферона, в частности, рекомбинантного ИФН-α2 у пациенток группы риска по невынашиванию беременности.
Таким образом, увеличение индуцированной выработки ИФН-α по сравнению с ИФН-γ в 5 и более раз у беременных с наличием УГИ и явлениями угрозы прерывания беременности могут быть использованы как маркеры осложненного течения беременности, что позволит своевременно проводить симптоматическую и патогенетическую терапию.
Выявленные изменения в интерфероновом статусе у пациенток с ПР и реализацией ВУИ, высокая (82,0%) чувствительность лейкоцитов к препаратам ИФН-α (роферон А, интрон А) у обследованных беременных с ПР являются основанием для проведения более масштабных исследований, которые позволили бы определить целесообразность назначения препаратов интерферона у пациенток с невынашиванием беременности.
Выводы
- Факторами риска развития ПР и реализации ВУИ у плода и новорожденного являются: наличие УГИ во время беременности в сочетании с хроническими воспалительными заболеваниями органов малого таза, хроническими экстрагенитальными заболеваниями.
- У беременных с ПР на фоне высокого уровня экспрессии гена ИФН-γ продукция его в культуре лейкоцитов снижена, что свидетельствует о нарушении продукции ИФН-γ на посттранскрипционном уровне.
- Соотношение индуцированной продукции ЛПК ИФН-α к ИФН-γ в 5 раз и более позволяет с высокой точностью прогнозировать ПР.
- Наиболее высокой чувствительностью (82,0%) к препаратам ИФН-α (роферону А, интрону А) обладают лейкоциты беременных в группе с УГИ и ПР, то есть с наиболее выраженными изменениями интерферонового статуса.



