В связи с интенсивным развитием вспомогательных репродуктивных технологий (ВРТ) возросла необходимость в индивидуализации протоколов стимуляции суперовуляции с использованием клинических, гормональных, генетических и функциональных маркеров овариального ответа [1–3]. При этом прогноз качества получаемых гамет и эмбрионов представляет собой одну из наиболее трудноразрешимых проблем при лечении пациенток методом экстракорпорального оплодотворения (ЭКО). Предложены различные маркеры исходов программ ВРТ (возраст, овариальный резерв, гормональный статус и другие) [2, 4, 5]. Генетическая предрасположенность представляется важным фактором, детерминирующим процессы фолликуло-, оо- и эмбриогенеза в программе ЭКО [6, 7].
Данные, полученные при исследовании генома, не меняются с возрастом, не зависят от веса, от дня менструального цикла и так далее, и могут определяться однократно, в отличие от гормональных маркеров. Исследование влияния генетических маркеров продолжает формировать научный и практический интерес современной медицины.
В литературе описаны созданные однофакторные модели, основанные на молекулярно-генетических предикторах, позволяющие прогнозировать овариальный ответ на стимуляцию суперовуляции и качество полученных гамет и эмбрионов [2, 8–10]. Однако недостатками таких моделей являются относительно низкая предиктивная способность и противоречивость данных [11].
Задача данного исследования – создать комплексную мультигенную модель прогнозирования получения незрелых ооцитов в программах ВРТ путем предварительного генотипирования пациенток. Исследование полиморфизма гена может служить мало инвазивным, нетрудоемким, недорогим тестом перед началом стимуляции функции яичников, позволяющим анализировать одновременно большое количество образцов.
Материал и методы исследования
Проведено проспективное исследование на базе отделения вспомогательных технологий в лечении бесплодия и лаборатории молекулярно-генетических методов ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России.
В исследование включены 160 пациенток, соответствовавшиt критериям включения (возраст 18–36 лет, женское бесплодие трубного происхождения, мужской фактор бесплодия при отсутствии выраженной патозооспермии, регулярный менструальный цикл) и исключения (эндокринный фактор бесплодия, перенесенные оперативные вмешательства на яичниках, эндометриоз, миома матки, генетические аномалии, пороки развития половых органов и другие).
Пациентки были разделены на 3 группы в зависимости от типа овариального ответа на стимуляцию суперовуляции: группа с нормальным овариальным ответом на стимуляцию суперовуляции (n=80), предполагавшим рост от 4 до 10 фолликулов; группа с «бедным» овариальным ответом на стимуляцию суперовуляции (согласно Bologna criteria, ESHRE 2011) (n=40) [12], группа с гиперовариальным ответом на стимуляцию суперовуляции (согласно Educational Bulletin American Society of Reproductive Medicine, 2008) (n=40) [13, 14].
Стимуляция функции яичников всем пациенткам проводилась со 2–3-го дня цикла по стандартному протоколу c антагонистом гонадотропин-рилизинг гормона (антГнРГ) препаратом рекомбинантного фолликулостимулирующего гормона (рФСГ) ежедневная доза препарата? в течение 9,8±0,9 дня. Ультразвуковой контроль динамики фолликулогенеза осуществлялся трансвагинально 4–5-кратно в течение стимуляции суперовуляции. При достижении диаметра максимального фолликула >14–15 мм ежедневно вводился препарат антГнРГ в дозе 0,25 мг. Финальное дозревание фолликулов достигалось введением препарата хорионического гонадотропина человека (ХГЧ) в дозе 8000–10 000 МЕ.
Трансвагинальная пункция фолликулов осуществлялась спустя 36 часов после введения ХГЧ. Оплодотворение аспирированных ооцитов проводилось как методом ЭКО (73/160, 45,6%), так и ИКСИ (87/160, 54,4%).
Для проведения генетического исследования производился забор периферической венозной крови по стандартной методике. В качестве потенциальных молекулярно-генетических предикторов степени зрелости полученных ооцитов исследовались 10 полиморфных локусов генов: AMH 146 G>T (Ile49Ser) [rs 10407022]; AMHR2(-482 A>G) [rs 2002555]; ESR1 –397 T>C [PvuII] [rs2234693]; ESR1–351 A>G [XBaI] [rs 9340799]; FSHR 2039 G>A (Ser680Asn) [rs 6166]; LHCGR 935 A>G (Asn312Ser) [rs 2293275]; VEGFA -634 G>C [rs 2010963]; ESR2 G>A [RsaI] [rs 4986938]; LHCGR 872 A>G (Asn291Ser) [rs 12470652]; SERPINE1 (PAI-1) -675(5G>4G) [rs 1799889]. Определяли генотип по данным позициям с применением полимеразной цепной реакции (ПЦР). ПЦР и определение температуры плавления олигонуклеотидных проб проводили при помощи детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Исследование было одобрено комитетом по этике ФГБУ НЦАГиП им. В.И. Кулакова МЗ РФ. Статистическая обработка данных выполнена с помощью пакета прикладных программ SPSS Statistics 17.0. В качестве меры центральной тенденции количественных признаков была выбрана медиана (Me), а в качестве интервальной оценки – верхний (H) и нижний квартили (L). Результаты представлены в виде Me (L-H). Для оценки значимости межгрупповых различий нескольких независимых выборок использовали тест Крускала–Уоллиса. В случае двух выборок применялся U-критерий Манна–Уитни для несвязанных совокупностей. Оценку соответствия выявленных частот генотипов закону Харди–Вайнберга проводили по критерию χ2 в сравнении с ожидаемыми частотами генотипов равновесного распределения. Достоверность различий в частоте встречаемости качественных признаков определяли по критерию χ2. При построении бинарной логистической регрессионной модели использовался метод обратной селекции. Качество приближения регрессионных моделей при каждом последующем шаге оценивалось при помощи функции подобия – отрицательного удвоенного значения логарифма этой функции (-2LL). Оценка качества полученных моделей проводилась с помощью ROC-анализа. Часть дисперсии, объяснимая с помощью логистической регрессии, вычислялась по методу Наделькеркеса. Статистически значимыми считались различия при р<0,05. Отношение шансов (ОШ) приведено с 95% доверительным интервалом (ДИ).
Результаты исследования
При проведении анализа анамнестических данных, росто-весовых показателей пациенток с различным типом овариального ответа различий выявлено не было. По типу и этиологии бесплодия, по структуре перенесенных гинекологических заболеваний и оперативных вмешательств группы пациенток были сравнимы между собой (р>0,05). При наличии мужского фактора бесплодия без выраженной патозооспермии оплодотворение ооцитов производилось методом ИКСИ. Статистически значимых различий между тремя исследуемыми группами по данному показателю выявлено не было (χ2, р=0,128).
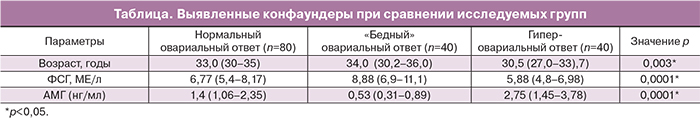
В группе с гиперовариальным ответом отмечалось увеличение числа пациенток в возрасте моложе 30 лет, уровень ФСГ в крови был ниже, антимюллерова гормона (АМГ) – выше по сравнению с пациентками с нормальным и «бедным» овариальным ответом. При проведении дальнейшего анализа данные факторы учтены как конфаундеры (таблица).
Был проведен поиск ассоциации генетических маркеров со степенью зрелости получаемых ооцитов. С целью создания комплексного многофакторного прогностического алгоритма проведено математическое моделирование. Построена математическая модель на основании генетических факторов.
Бинарная логистическая регрессия позволяет рассчитать вероятность наступления события (в данном случае получение незрелых ооцитов) в зависимости от значений независимых переменных (в данном случае полиморфизма исследуемых генов).
Вероятность наступления события (получения незрелых ооцитов) (р) для некоторого случая рассчитывается по формуле, имеющий общий вид:
p=1/(1+e-z),
где p – искомая вероятность наступления события; z (классифицирующая дискриминантная функция) = a+b1×X1+b2×Х2+ ...+ bn×Xn, а – некоторая константа; X1 – независимые переменные; b1 – коэффициенты, расчет которых является задачей бинарной логистической регрессии.
Если для р получается значение меньшее 0,5, то можно предположить, что событие не наступит; в противном случае предполагается наступление события.
Проведенный нами анализ позволил прогнозировать получение зрелых ооцитов на основании генотипа пациентки. Анализ был проведен в несколько этапов, сначала были вовлечены все генотипы, затем исключены наименее значимые.
Согласно полученной константе и согласно значимым коэффициентам для прогнозирования вероятности получения незрелых ооцитов (р) классифицирующая дискриминантная функция имеет вид:
Z = 23,601 – 1,131* AMHR2A/G – 0,672* AMHR2G/G + 0,932* ESR2А/А + 0,168* ESR2A/G – 0,606* LHCGR (935 A>G)A/G – 1,435*LHCGR (935 A>G)A/A – 23,065* LHCGR (872 A>G)A/G – 23,627*LHCGR (872 A>G)A/A
где AMHR2A/G – наличие у пациентки генотипа AMHR2: -482 A/G (1 – да, 0 – нет);
AMHR2G/G – наличие у пациентки генотипа AMHR2: -482 G/G (1 – да, 0 – нет);
ESR2А/А – наличие у пациентки генотипа ESR2: А/А (1 – да, 0 – нет);
ESR2A/G – наличие у пациентки генотипа ESR2: А/G (1 – да, 0 – нет);
LHCGR (935 A>G)A/G – наличие у пациентки генотипа LHCGR: 935 A/G (1 – да, 0 – нет);
LHCGR (935 A>G)A/A – наличие у пациентки генотипа LHCGR: 935 A/А (1–да, 0–нет);
LHCGR (872 A>G)A/G – наличие у пациентки генотипа LHCGR: 872 A/G (1 – да, 0 – нет);
LHCGR (872 A>G)A/A – наличие у пациентки генотипа LHCGR: 872 A/А (1 – да, 0 – нет).
Часть дисперсии, объяснимой с помощью логистической регрессии, в данном уравнении составляет 16,1% (вычисляется по методу Наделькеркеса).
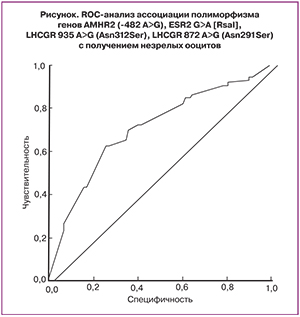 Точность прогнозирования получения незрелых ооцитов с использованием полиморфизма генов AMHR2 (-482 A>G), ESR2 G>A [RsaI], LHCGR 935A>G (Asn312Ser), LHCGR 872A>G (Asn291Ser) составляет 68,6%. В заключение был проведен ROC-анализ для валидации полученной модели (рисунок). Чувствительность составила 73,6%, специфичность – 62,5%, значение AUC (площадь под ROC-кривой) для данной модели составляет 0,704, 95% доверительный интервал от 0,622 до 0,786.
Точность прогнозирования получения незрелых ооцитов с использованием полиморфизма генов AMHR2 (-482 A>G), ESR2 G>A [RsaI], LHCGR 935A>G (Asn312Ser), LHCGR 872A>G (Asn291Ser) составляет 68,6%. В заключение был проведен ROC-анализ для валидации полученной модели (рисунок). Чувствительность составила 73,6%, специфичность – 62,5%, значение AUC (площадь под ROC-кривой) для данной модели составляет 0,704, 95% доверительный интервал от 0,622 до 0,786.
Пример
Прогнозирование получения незрелых ооцитов провели у пациентки Х 28 лет, обратившейся для проведения программы ЭКО по поводу трубно-перитонеального фактора бесплодия. Из анамнеза: беременностей 0, в 2011 г. произведена лапароскопия, двухсторонняя тубэктомия по поводу гидросальпинксов. Данная попытка ЭКО первая.
Кровь для генотипирования у пациентки Х брали натощак из локтевой вены в стерильную пробирку. Определяли однонуклеотидные замены с применением ПЦР.
Результат генотипирования пациентки Х:
AMHR2(-482 A>G) – A/G
ESR2 G>A [RsaI] – A/G
LHCGR 935 A>G – А/А
LHCGR 872 A>G – A/А
Значение дискриминантной функции составило:
z=23,601–1,131×1+0,168×1–1,435×1–23,627×1= –2,424
Вероятность (р) получения незрелых ооцитов у данной пациентки рассчитывали по формуле (1):
р=1/(1+е-2,424)=0,925
Рассчитанная вероятность р указывает на исполнение прогноза (получение незрелых ооцитов) с вероятностью 92,5%.
В результате проведения программы ВРТ у пациентки всего было получено 11 ооцитов, из них 9 ооцитов – незрелые, 2 – зрелые.
Согласно полученным данным прогноз получения незрелых ооцитов при проведении программ ВРТ носит статистически достоверный характер.
Полученный результат свидетельствует о независимой генетической детерминации процессов оогенеза. Следовательно, способ прогнозирования получения незрелых ооцитов в программах ВРТ с использованием молекулярно-генетических маркеров может быть использован в клинико-лабораторной практике с целью предикции исходов программы ЭКО.
Обсуждение
Основной задачей стимуляции функции яичников в программах ЭКО является получение достаточного числа зрелых ооцитов с целью выбора высококачественных эмбрионов для переноса в полость матки.
В последнее время особую актуальность приобрело такое понятие, как персонифицированная медицина, являющаяся достаточно новой для отечественной практики, широко внедряющаяся в различные направления здравоохранения. Под этим подразумевают методы профилактики, диагностики и лечения, основанные на данных об индивидуальных особенностях пациентки, в том числе и генетической предрасположенности к тому или иному заболеванию, состоянию или функции организма [15].
Генетическая вариабельность представляется важным предиктором исходов стимуляции суперовуляции и программ ВРТ в целом. В литературе встречаются достаточно редкие попытки создания мультигенных моделей. Так, в исследовании, проведенном на популяции индийских женщин, в ходе анализа установлено, что у гомозиготных женщин по аллелю 680Ser полиморфизма гена FSHR (Asn680Ser) [rs 6166] и 49Ser гена AMH (Ile49Ser) [rs10407022], получают большее количество зрелых ооцитов, чем у пациенток, гомозиготных по аллелю 680Asn полиморфизма гена FSHR (Asn680Ser) и/или гомозиготных по аллелю 49Ile гена AMH (Ile49Ser) (p=0,009) [16].
В другом исследовании, проведенном на популяции европейских женщин, были представлены данные анализа мультигенной модели 680Ser (FSHR 2039 A>G) – T (ESR1 [PvuII]) – G (ESR2 [AluI]), которая прогнозировала «бедный» овариальный ответ на стимуляцию суперовуляции препаратами рФСГ, но не было выявлено ассоциации полиморфизма гена с качеством ооцитов и эмбрионов [2].
В проведенном нами исследовании четко продемонстрирована ассоциация генотипа пациенток с исходами стимуляции суперовуляции, а именно со степенью зрелости полученных ооцитов. Проведенный анализ позволяет планировать лечебную и эмбриологическую тактику еще на этапе подготовки пациентки к проведению программы ЭКО. Так, согласно клиническим и научным исследованиям, в том числе и рандомизированным, при получении незрелых ооцитов рекомендуется их дозревание в специальной культуральной среде, а при последующем оплодотворении целесообразно исключить процедуру ИКСИ [17, 18].
Таким образом, разработка панелей генетических маркеров биологических процессов, происходящих в гаметах, является перспективной предпосылкой для персонификации программ ВРТ, что может значительно повысить шанс успешных исходов в программах ВРТ и рождения здоровых детей.
Заключение
Сегодня очевидна перспективность использования биоинформационных подходов и математического моделирования для создания комплексных многофакторных прогностических алгоритмов.
Генетическая предрасположенность к формированию того или иного исхода стимуляции суперовуляции не имеет выраженных специфических клинических проявлений. Молекулярно-генетическое исследование позволяет заблаговременно выявить данную предрасположенность, что помогает правильно оценить конкретную клиническую ситуацию.
Подано заявление о выдаче патента РФ на изобретение «Способ прогнозирования получения незрелых ооцитов в программах вспомогательных репродуктивных технологий с использованием молекулярно-генетических маркеров» (дата 27.11.2014г, входящий № 076619, регистрационный № 2014147641).



