АННОТАЦИЯ
Миома матки — доброкачественная, моноклональная, хорошо отграниченная, капсулированная опухоль, происходящая из гладкомышечных клеток шейки или тела матки – одна из наиболее распространенных доброкачественных опухолей женской половой сферы, которая возникает у 20-40% женщин репродуктивного возраста. Локализация миомы матки бывает самой разнообразной. Наиболее часто диагностируют субсерозное и межмышечное (интрамуральное) расположение миоматозных узлов, количество которых может достигать 25 и более, а размеры – значительно увеличиваться. Подслизистое (субмукозное) расположение узлов наблюдают реже, но оно сопровождается более яркой клинической картиной.
В этих рекомендациях представлены современные данные об этиологии, патогенезе, клинической картине, диагностике, а также о новых возможностях хирургического лечения и роли гормональной терапии в комплексном лечении миомы матки.
1. ЭПИДЕМИОЛОГИЯ, ЭТИОЛОГИЯ, ПАТОГЕНЕЗ И ФАКТОРЫ РИСКА
Миома матки – наиболее распространенная доброкачественная опухоль среди женщин большинства стран мира. Считают, что миому матки диагностируют у 30—35% женщин репродуктивного возраста, чаще в позднем репродуктивном возрасте, а у 1/3 пациенток она становится симптомной.
Как следствие, миома матки становится главной причиной гистерэктомии во многих странах, например в США она является основанием приблизительно для 1/3 всех гистерэктомий, а это примерно 200 тыс. гистерэктомий ежегодно. В России, по различным данным, миома матки является причиной гистерэктомии в 50—70% случаев при заболеваниях матки.
Несмотря на высокую распространенность заболевания, до последних лет сравнительно немного фундаментальных исследований было направлено на выявление причинной обусловленности и патогенеза миомы матки из-за редкости ее злокачественного преобразования. Однако, несмотря на доброкачественное течение, миома матки является причиной значительного снижения качества жизни у значительной части женского населения. Клинические проявления опухоли связаны с маточными кровотечениями, болью, сдавливанием смежных органов, нарушением не только их функции, но и фертильности, включая бесплодие и невынашивание беременности.
Причины развития миомы матки неизвестны, но научная литература содержит большой объем информации, имеющий отношение к эпидемиологии, генетике, гормональным аспектам и молекулярной биологии этой опухоли.
Факторы, потенциально связанные с генезом опухоли, можно условно представить 4 категориями:
- предрасполагающие или факторы риска;
- инициаторы;
- промоутеры;
- эффекторы.
Факторы риска миомы матки (предрасполагающие)
Знание факторов предрасположенности позволит иметь представление об этиологии миомы матки и разработать превентивные меры. Несмотря на то, что мы рассматриваем факторы риска изолированно, чаще всего на лицо их сочетание (табл. 1). Воздействие многих факторов ранее приписывали их влиянию на уровень или метаболизм эстрогенов и прогестерона, но доказано, что эта связь чрезвычайно сложна, и скорее всего, существуют другие механизмы, вовлеченные в процесс образования опухоли. Следует отметить, что анализ факторов риска миомы матки остается трудной задачей в связи с относительно небольшим количеством проведенных эпидемиологических исследований, а на их результаты может оказывать влияние тот факт, что распространенность бессимптомных случаев миомы матки достаточно высока [Schwartz S.M., Marshall L.M., 2000].
Самый важный аспект этиологии миомы матки — инициатор роста опухоли — остается неизвестным, хотя теории инициирования ее туморогенеза существуют. Одна из них подтверждает, что увеличение уровня эстрогенов и прогестерона приводит к росту митотической активности, которая может способствовать формированию узлов миомы, увеличивая вероятность соматических мутаций. Другая гипотеза предполагает наличие врожденной генетически детерминированной патологии миометрия у женщин, больных миомой матки, выраженной в увеличении количества РЭ в миометрии. Наличие генетической предрасположенности к миоме матки косвенно свидетельствует об этническом и семейном характере заболевания.

Кроме того, риск заболеваемости миомой матки выше у нерожавших женщин, для которых, возможно, характерно большое количество ановуляторных циклов, а также ожирение с выраженной ароматизацией андрогенов в эстрон в жировой ткани. Согласно одной из гипотез, основополагающую роль в патогенезе миомы матки играют эстрогены.
Эта гипотеза подтверждена клиническими испытаниями, оценивавшими эффективность лечения миомы матки агонистами гонадотропин-рилизинг гормона (аГнРГ), на фоне терапии наблюдали гипоэстрогенемию, сопровождаемую регрессом миоматозных узлов. Тем не менее, говорить об основополагающей важности эстрогенов независимо от прогестерона нельзя, так как содержание прогестерона в крови, подобно эстрогенам, циклически изменяется в течение репродуктивного возраста, а также значительно повышено во время беременности и снижено после менопаузы. Таким образом, клинические и лабораторные исследования свидетельствуют о том, что и эстрогены, и прогестерон могут быть важными стимуляторами роста миомы
3. ТЕРМИНОЛОГИЯ И КЛАССИФИКАЦИЯ
Терминология. Сведения о миоме матки имелись еще у древних врачевателей. При исследовании останков древнеегипетских мумий были выявлены случаи кальцифицированных узлов миомы матки. Гиппократ называл их «камнями матки».
С. Von Rokitansky (1860) и J.M. Klob (1863) предложили термин «фиброид». R.L.Virchov продемонстрировал гладкомышечное происхождение этих опухолей и впервые использовал термин «миома». T. Billroth предложил называть их «миофибромами», a Mallory – термином «лейомиома». S. Ashwell (1844) и J.H. Bennett (1845) окончательно определили термин «миома» и «рак матки».
Классификации. Клинико-анатомическая классификация основана на следующих принципах: локализация в различных отделах матки и рост опухоли по отношению к мышечному слою матки:
- интрамуральные,
- субмукозные,
- субсерозные,
- межсвязочные,
- шеечные,
- паразитарные.
В 95% наблюдений опухоль располагается в теле матки и в 5% – в ее шейке.
Классификация ВОЗ в зависимости от степени их дифференцировки:
- обычная лейомиома – зрелая доброкачественная опухоль,
- клеточная лейомиома,
- причудливая лейомиома,
- лейомиобластома – эпителиоидная лейомиома,
- внутрисосудистый лейомиоматоз,
- пролиферирующая лейомиома,
- лейомиома с явлениями предсаркомы (малигнизирующаяся).
В зависимости от количества узлов миома матки может быть:
- одиночной,
- множественной.
В 1995 г. Европейской ассоциацией гистероскопистов (ЕАГ) принята гистероскопическая классификация субмукозных узлов, предложенная Wamsteker и deBlok [Wamsteker K. et al., 1993], определяющая тип узлов в зависимости от интрамурального компонента:
- субмукозные узлы на ножке без интрамурального компонента,
- субмукозные узлы на широком основании с интрамуральным компонентом менее 50%.
II. Миоматозные узлы с интрамуральным компонентом 50% и более.
Согласно рекомендациям Европейского общества репродукции человека (ESHRE), небольшими следует считать миомы до 5 см, большими – миомы более 5 см.
Международная классификация болезней десятого пересмотра (МКБ 10):
- D25 Лейомиома матки
- D25.0 Подслизистая лейомиома матки
- D25.1 Интрамуральная лейомиома
- D25.2 Субсерозная лейомиома
- D25.9 Лейомиома неуточненная
- D26 Другие доброкачественные новообразования матки
- D26.0 Доброкачественное новообразование шейки матки
- D26.1 Доброкачественное новообразование тела матки
- D26.7 Доброкачественное новообразование других частей матки
- D26.9 Доброкачественное новообразование матки неуточненной части
- 034.1 Опухоль тела матки (при беременности), требующая предоставления медицинской помощи матери
4. КЛИНИЧЕСКАЯ КАРТИНА
Миома матки длительное время может протекать без выраженных клинических проявлений. Симптомы миомы матки могут быть изолированными или в различных сочетаниях, включая маточные кровотечения, боль, нарушения функции смежных органов, бесплодие, гиперплазию эндометрия, мелкокистозные изменения яичников, дисгормональные заболевания молочных желез.
Клиническая картина миомы матки зависит от ряда факторов.
По локализации и направлению роста миома матки может быть субсерозной (как особые варианты – паразитирующая на смежных органах, интралигаментарная), интерстициальной, субмукозной. Важную роль в появлении клинических симптомов играет и расположение узлов по отношению к оси матки: шеечная, перешеечная и корпоральная.
При субсерозной корпоральной миоме на широком основании симптомы, как правило, отсутствуют, так как функциональная активность матки не меняется.
Симптомная миома матки чаще развивается при атипичных локализациях узлов больших размеров.
Шеечно-перешеечная локализация миоматозного узла визуализируется при влагалищном исследовании сглаживанием передней, задней губы либо всей шейки со смещением наружного зева к противоположной локализации узла стенке таза.
Расположение субсерозного или интерстициального узла в области перешейка (антецервикальная локализация) обусловлено нарушениями функции мочеиспускания за счёт сдавления и нарушения иннервации мочевого пузыря. При парацервикальной – узел исходит из боковых отделов шейки матки. Возможен конфликт с мочеточником, который бывает сложно катетеризировать до операции, мочеточник может быть распластан на узле. Субперитонеальную миому, отслаивающую брюшину от задней поверхности передней брюшной стенки, диагностируют очень редко. Возможен конфликт с мочевым пузырем при вхождении в брюшную полость. Функция мочеиспускания может восстанавливаться в течение нескольких месяцев после операции. Ретроцервикальная локализация – узел исходит из задней поверхности шейки матки, растет в сторону прямой кишки с симптомами сдавления ее, появлением запоров, изредка – лентообразного кала. При развитии подбрюшинного узла из задней стенки матки над областью внутреннего зева образуется узел ретроперитонеальной локализации. Он отслаивает брюшину от позвоночника, возникает конфликт с мочеточником, возможно развитие гидроуретера, гидронефроза и пиелонефрита. Узлы опухоли могут сдавливать крестцовые нервы и вызывать корешковую боль – так называемый вторичный ишиас. Параметральный рост миомы также вызывает болевую симптоматику, так как давит на сплетения, возможно нарушение кровообращения в области малого таза, развивается венозный застой, а также тромбоз вен малого таза и нижних конечностей.
При наличии миоматозного узла, расположенного по задней стенке тела матки, самым частым клиническим симптомом является ноющая боль в крестце и пояснице.
Межмышечные миомы нарушают сократительную способность миометрия, увеличивают и деформируют полость матки и площадь эндометрия. При этом утолщается срединный слой миометрия, нарушается микроциркуляция и как результат – длительные и обильные маточные кровотечения.
Маточные кровотечения, наблюдаемые у 70% больных, являются наиболее частой причиной оперативного вмешательства при миоме матки.
Причинами обильных менструальных кровотечений (ОМК), кроме названных выше, могут быть образование сосудов эндотелиального типа в процессе образования миомы, венозный застой при опущении «отяжелевшей» матки, нарушение кровообращения в толще миометрия вследствие расширения венозных сплетений мио- и эндометрия в сочетании с усилением артериального кровоснабжения, появление гиперплазии эндометрия как следствия «стимуляции потреблением», вторичные изменения в системе гемостаза и субмукозная локализация миоматозного узла. ОМК наиболее характерны для быстрорастущей миомы.
Для субмукозной миомы не существует понятия «клинически незначимый размер». Субмукозные узлы подлежат удалению. Для субмукозных узлов, деформирующих полость матки (I типа), и узлов на ножке (0 типа) типичны периодически возникающая схваткообразная боль внизу живота, аномальные маточные кровотечения по типу ОМК и межменструальных маточных кровотечений (ММК), а также появление жидких выделений с ихорозным запахом из влагалища. Боль и выделения усиливаются в период менструации. После ее окончания, когда шейка матки частично закрывается, клинические симптомы ослабевают.
Болевой синдром у каждой третьей больной миомой матки проявляется в виде вторичной дисменореи, схваткообразной боли при субмукозном расположении узла, ноющей боли при быстром росте, больших размерах, межсвязочном расположении опухоли, сдавлении соседних органов, дегенеративных изменениях в узле и сопутствующих воспалительных заболеваниях гениталий.
При перекруте ножки субсерозного узла развивается клиническая картина острого живота: резкая боль внизу живота и пояснице с последующим появлением симптомов раздражения брюшины (тошнота, рвота, повышение температуры тела, лейкоцитоз, ускорение СОЭ, нарушение функций мочевого пузыря и прямой кишки). При клинической картине необходима дифференциальная диагностика с перекрутом кисты яичника, острым аднекситом, аппендицитом, внематочной беременностью.
Грозным, но редким осложнением является разрыв кровеносного сосуда миомы с кровотечением в брюшную полость. Прослеживается причинная связь данного осложнения с травмой или подъемом тяжестей, иногда причину выяснить не удается. Предрасполагающим фактором в ряде случаев оказывается беременность. Для клинической картины данного осложнения характерны внезапная резкая боль кинжального характера и признаки внутрибрюшного кровотечения с развитием шока, коллапса. Диагноз устанавливают интраоперационно.
Особенность клинических проявлений миомы – сочетание ее с другими заболеваниями и системными изменениями в организме. Миома матки – болезнь дезадаптации. Заболевание полисистемно: сочетается с ожирением (64%), гипертонической болезнью, ишемической болезнью сердца (60%), заболеваниями желудочно-кишечного тракта (40%), щитовидной железы (4,5%), неврозами (11%) и с патологией молочных желёз (86%). Закономерно, что системные изменения в организме накапливаются с возрастом, усугубляются также и клинические проявления миомы матки. Установлены возрастные особенности течения миомы.
Заболевание не наблюдают у девочек до менархе. С появлением менструаций можно обнаружить миому матки. Случаи имеют единичный характер, прослеживается отягощенная наследственность по наличию миомы матки у близких родственников.
Для современной миомы матки характерно выявление в более молодом возрасте. За 40 лет частота возникновения миомы матки в возрасте до 30 лет увеличилась с 2 до 12,5%.
Миоциты в матке молодой женщины имеют средние размеры, структура миометрия плотная, пластичная. С возрастом, к 30–35 годам, они становятся крупнее, снижается адаптация к функциональным нагрузкам. Эластические и коллагеновые волокна, составляющие каркас для пучков и слоев миометрия, частично замещаются более грубыми и хрупкими соединительнотканными волокнами.
С 35 лет снижаются функциональная активность яичников и продукция стероидных гормонов. По принципу отрицательных обратных связей гипоталамус усиливает не только выброс гонадотропных гормонов, но и гонадотропную стимуляцию яичников, формируются ановуляторные циклы.
Узлы, имеющие размеры до 15 мм, подчинены гормональному фону и их размеры под влиянием гормональной терапии могут стабилизироваться. Далее, с увеличением размеров узлов, появляются автономные механизмы роста, узел уже имеет соединительнотканное стабильное ядро и регрессируемую периферическую часть. В возрасте 25‒35 лет миоматозные узлы обнаруживают при УЗИ, наступившей беременности или профилактическом осмотре.
Репродуктивный потенциал больных миомой матки: на каждую приходится 4‒5 беременностей, вместе с тем, большинство из них (3‒4) оканчивается абортами.
Чем больше продолжительность заболевания, тем чаще выявляют нарушения репродуктивной функции. Нейроэндокринные изменения в гипоталамо-гипофизарно- яичниковой и надпочечниковой системах приводят к прогрессии миомы матки и бесплодию.
По данным Е.М. Вихляевой (1998), средний возраст выявления миомы матки составляет 33–35 лет. Через 10 лет у большинства больных (40–65%) прогрессирует опухоль, поэтому необходимо хирургическое лечение. Установлено, что даже после появления субъективных ощущений до обращения к врачу проходит 1–3 года.
Быстрый рост миоматозного узла в репродуктивном возрасте зарегистрирован у 48‒60% больных. Фоном для этого являются преждевременное прекращение репродуктивной функции или запоздалая ее реализация; нарушение корреляционной зависимости между синтезом стероидных гормонов в яичниках и гонадотропной стимуляцией; избыточная масса тела, обеспечивающая внегонадный синтез эстрогенов; заболевания печени; хронические болезни кишечника, обеспечивающие энтерогепатическую рециркуляцию эстрогенов; сформировавшиеся рецидивирующие гиперпластические процессы в эндометрии; хронические воспалительные процессы гениталий, а также длительное отрицательное влияние факторов окружающей среды, воздействие наследственных факторов. Рост узла может быть ложным вследствие деструктивно-дистрофических изменений, отека на фоне воздействия высоких концентраций эстрадиола и низких прогестерона, а также активации урогенитальной инфекции. Истинный быстрый рост миомы матки – пролиферативная опухоль – чаще наблюдают у женщин в пре- и пост менопаузе (в 8,4% случаев).
В пременопаузальном возрасте прекращение гормональной функции яичников происходит постепенно, в среднем в течение 5 лет. Снижается чувствительность яичников к гонадотропной стимуляции. Недостаток яичниковых эстрогенов частично компенсируется повышением массы тела в перименопаузальном возрасте. Гиперэстрогения, обусловленная внегонадной продукцией эстрона, способствует возникновению гиперпластических процессов в гормонозависимых тканях. Частота патологических кровотечений у больных с миомой матки в возрасте 40-50 лет составляет 48-58%.
Повышается частота сочетания миомы матки с аденомиозом, что отчасти связано с возрастным изменением структуры эндометрия. С возрастом базальный слой эндометрия глубже проникает в миометрий, создавая условия для развития аденомиоза. Есть мнения, что в возрасте 50 лет поверхностный аденомиоз имеется у 85-90% женщин.
Быстрый рост узлов в совокупности с аномальными маточными кровотечениями, гиперпластическими процессами эндометрия и развитием хронической постгеморрагической анемии у большинства пациенток в этом возрастном периоде является основным показанием к субтотальной или тотальной гистерэктомии.
При миоме матки в 2‒2,5 раза чаще, чем в популяции, развивается климактерический синдром, что отражает истощение защитно-приспособительных механизмов. Тяжелое течение климактерического синдрома у больных миомой матки наблюдают у каждой второй пациентки – расплата за отягощенный акушерско- гинекологический анамнез – нереализованный репродуктивный потенциал, аборты, неадекватная контрацепция, множество перенесенных воспалительных заболеваний органов малого таза.
Менопауза наступает на 1‒3 года позже у больных с миомой матки, чем у здоровых женщин. Преобладающим эстрогеном становится эстрон с низкой гормональной активностью, но способный на молекулярном уровне усиливать экспрессию онкогенов и факторов роста. С наступлением менопаузы прогрессивно уменьшаются размеры матки, с сохранением гиалинизированных узлов, которые не способны уменьшаться в силу особенностей стромального компонента. Отсутствие регресса миомы матки или даже увеличения ее размеров не является гормонозависимым или гормонально обусловленным процессом. В менопаузе имеется стабильно высокая продукция гонадотропинов, которые являются прямыми ингибиторами апоптоза и посредниками-индукторами пролиферации.
Если миома матки не регрессирует в первые 1‒2 года постменопаузы, ее дальнейшее существование сопровождается опасностью возникновения рака эндометрия, яичников, саркомы матки. Основными клиническими симптомами нерегрессирующей миомы матки в постменопаузе служат поздняя менопауза; кровянистые выделения из матки после одного года стойкой менопаузы; отсутствие регрессии миоматозных узлов и возрастной инволюции матки в первые 1‒2 года менопаузы; патология эндометрия; увеличение толщины М-эхо до 5‒8 мм и более в сочетании с миомой матки; патология яичников; хроническая анемия, не обусловленная другими причинами.
Онкологическую настороженность должны вызывать женщины, вступающие в менопаузу с большими размерами опухоли, узлами субмукозной локализации или с центрипетальным ростом, с рецидивирующей и атипической гиперплазией эндометрия, при сочетании миомы матки и аденомиоза II-III степени, при отсутствии регресса миомы, существующей на фоне длительной возрастной инволюции матки. Этот вариант особенно опасен, так как пролиферативные процессы в миоматозных узлах гормонально независимы. Такие миомы являются этапом на пути появления саркомы.
5. ДИАГНОСТИКА
Ультразвуковая диагностика матки
Основным методом скрининга и первичной диагностики в гинекологии, «золотым стандартом» инструментальной диагностики в этой области без сомнения было и остается УЗИ. В то же время достоверность результатов УЗИ зависит не только от опыта и знаний врача-диагноста, но и от его мануальных навыков владения УЗИ-датчиком, т.е. УЗИ является достаточно субъективным или «операторзависимым» методом. Нельзя не отметить объективные ограничения метода – необходимость иметь в области исследования акустические окна нужного размера, что не всегда возможно.
Однако ультразвуковое исследование с помощью трансабдоминального и трансвагинального датчиков является методом первичной диагностики миомы матки, а также его широко используют для динамического наблюдения за развитием опухолевого процесса, отбора пациенток и оценки эффективности различных видов (консервативное и/или хирургическое) лечебного воздействия. На основании прогностических акустических признаков эхография предоставляет возможность не только топической диагностики миоматозных узлов, но и их структуры, гемодинамики и соответственно выраженности пролиферативных процессов, дифференциации с другой патологией миометрия (аденомиоз, саркома и др.).
Современные 3/40-технологшш позволяют получить в коронарной плоскости сканирования дополнительную информацию по пространственной локализации в отношении полости матки межмышечных с центрипетальным ростом и подслизистых узлов.
Эхогистерография на фоне инсталлированной жидкости и разведения стенок полости матки существенно расширяет возможности контурирования узла, тем самым детализируя его локализацию в полости матки. Так, при межмышечно-подслизистом расположении узла выявляют четкую структуру эндометрия, а при его подслизитой локализации – последний полностью располагается в полости матки. Полученная при эхогистерографии дополнительная информация облегчает выбор лечебных мероприятий.
Наряду с эхографической картиной структуры миоматозного узла при цветовом допплеровском картировании (ЦДК) оценивают качественные и количественные параметры его кровотока. В подавляющем большинстве случаев немозаичный кровоток регистрируют по периферии и лишь в 1/3 – внутри его. При так называемых пролиферирующих узлах тип кровотока диффузный или смешанный. Оценка количественных параметров кровотока при ЦДК позволяет предположить гистотип опухоли. Так, скорость кровотока (Vmax) в простой и пролиферирующей миоме невысока и находится в диапазоне от 0,12 до 0,25 см3/сек., а индекс резистентности (RI) – 0,58‒0,69 и 0,50‒0,56 соответственно. Высокая скорость артериального мозаичного кровотока (Vmax > 0,40 см3/сек) в совокупности с низкими показателями индекса резистентности (RI<0,40) позволяет заподозрить саркому матки.
Рентгенологическое исследование, компьютерная томография и магнитно-резонансная томография в диагностике миомы матки
В настоящее время рентгенологические исследования, используемые ранее для визуализации патологии матки и ее придатков (газовая и биконтрастная рентгенопельвиография, внутриматочная тазовая флебография и т.д.), имеют исторический характер и не получили развития вследствие возникновения других современных лучевых методов исследования. Традиционные рентгенологические исследования используют в ограниченных случаях и чаще всего только для диагностики трубного бесплодия – гистеросальпингография.
Применение современной мультисрезовой компьютерной томографии (МСКТ или КТ), особенно при искусственном контрастировании, позволяет с высоким разрешением не только определять состояние и взаимоотношение органов малого таза, костных структур и сосудов таза, но и диагностировать наличие кровотечений в остром периоде, а также внедрять в гинекологию методы интервенционной радиологии. КТ органов малого таза проводят чаще в положении пациентки на спине.
Однако методы лучевой диагностики, использующие ионизирующее излучение, в гинекологи, и особенно при обследовании девочек, девушек и женщин репродуктивного возраста по понятным причинам нежелательны из-за лучевой нагрузки, а это значит, что в подавляющем большинстве клинических случаев к ним следует прибегать только при строгих клинических показаниях, невозможности заменить их более безопасными методами или при проведении малотравматичных лечебных мероприятий, таких, например, как селективная сальпингография и рентгенохирургическая реканализация проксимальных отделов маточных труб при их непроходимости, эмболизация маточных артерий при лечении миом матки и др.
Спиральная/мультиспиральная компьютерная томография
При СКТ с контрастным внутривенным усилением миома определяют в виде мягкотканного образовани, вызывающего деформацию и/или выпячивание за пределы наружного контура матки или деформирующего полость матки. Миомы матки имеют четко очерченную капсулу и однородную структуру с мягкотканной плотностью – 40-60 HПри мультисрезовой спиральной КТ миом с введением рентгеноконтрастных средств можно получить данные о состоянии сосудов малого таза, что очень важно для выявления основного питающего сосуда при планировании рентгенохирургического лечения миомы эмболизацией маточной артерии.
Множественная миома определяется в виде единого конгломерата мягкотканной плотности с ровными четкими контурами, овальной формы с гомогенной внутренней структурой. При больших миомах можно наблюдать сдавление и деформацию мочевого пузыря, мочеточников. При развитии дегенеративно-некротических изменений структура миомы становится неоднородной, с зонами пониженной плотности вследствие нарушения кровоснабжения. При субмукозных миомах в центре матки определяют мягкотканное образование, повторяющее конфигурацию полости матки. Контуры его ровные, четкие, окружены гиподенсивным ободком эндометрия, оттесненным узлом. В паренхиматозную фазу контрастирования миоматозный узел четко выделяется на фоне окружающего миометрия. Нередко в миоматозных узлах образуются кальцинаты в виде единичных вкраплений и массивных участков.
Магнитно-резонансная томография
Миоматозные узлы на МР-томограммах представлены образованиями с четкими границами, с ровными или слегка бугристыми контурами. Как правило, характерной особенностью миоматозных узлов на МРТ, в I фазе менструального цикла является низкая интенсивность МР-сигнала на Т2ВИ, близкая к МР-сигналу от скелетных мышц. Реже миоматозные узлы выявляют в виде образований со средней интенсивностью МР-сигнала, изоинтенсивной миометрию, за счет выраженного содержания коллагена и особенностей кровоснабжения. Для небольших узлов более характерна их однородная структура. Минимальный диаметр выявляемых узлов около 0,3‒0,4 см. За более мелкие образования, по МР-характеристике аналогичные миоматозным узлам, могут быть приняты маточные сосуды, попавшие в срез томографа в поперечном сечении. Характеристика миоматозных узлов может меняться за счет не только резкого изменения кровотока при менструациях, но и дегенеративных процессов в узле. Реже определяют кистозную трансформацию, а также кровоизлияния в миоматозный узел, более характерные для крупных узлов, которые, как правило, имеют гетерогенную структуру.
В целом при МРТ органов малого таза независимо от фазы цикла можно выявить 5 типов миоматозных узлов:
- с однородным гипоинтенсивным МР-сигналом, аналогичным скелетным мышцам;
- с неоднородной преимущественно гипоинтенсивной структурой, но с участками гиперинтенсивных включений за счет дегенерации с формированием отека и гиалиноза;
- с изоинтенсивным МР-сигналом, аналогичным ткани миометрия, за счет малого содержания коллагена;
- с высоким МР-сигналом за счет кистозной дегенерации;
- с варьирующим МР-сигналом на Т2ВИ и высоким, с различной степенью интенсивности, на Т1ВИ при дегенеративных изменениях с кровоизлиянием.
Миомы с дегенеративными изменениями (гиалиновые, кистозные) имеют характерный пятнистый или гомогенный вид с неоднородным по интенсивности сигналом. При кальцификации миома выглядит как образование с равномерно высокой интенсивностью сигнала, четко очерченное кольцом низкой интенсивности от окружающего миометрия.
6. ЛЕЧЕНИЕ
Тактика ведения больных с миомой матки включает наблюдение и мониторинг, медикаментозную терапию, различные методы хирургического воздействия и использование новых мини-инвазивных подходов. Для каждой пациентки разрабатывают индивидуальную тактику ведения, т.е. подход должен быть строго персонифицированным.
6.1. Хирургическое лечение
Показания к хирургическому лечению
Большинству больных с миомой матки необходимо хирургическое лечение. Показания к операции выявляют примерно у 15% больных. Общепринятыми показаниями к хирургическому лечению являются: обильные менструальные
кровотечения, приводящие к возникновению анемии; хроническая тазовая боль, значительно снижающая качество жизни; нарушение нормального функционирования соседних с маткой внутренних органов (прямая кишка, мочевой пузырь, мочеточники); большой размер опухоли (более 12 нед беременной матки); быстрый рост опухоли (увеличение более чем на 4 нед беременности в течение 1 года); рост опухоли в постменопаузе; подслизистое расположение узла миомы; межсвязочное и низкое (шеечное и перешеечное) расположение узлов миомы; нарушение репродуктивной функции; бесплодие при отсутствии других причин.
Как правило, хирургическое лечение выполняют в плановом порядке в I фазу менструального цикла (5-14-й день). Экстренная операция необходима при спонтанной экспульсии («рождении») подслизистого миоматозного узла, при дегенеративных изменениях в опухоли вследствие нарушения кровообращения, сопровождающихся признаками инфицирования и возникновением симптоматики «острого живота», а также при неэффективности проводимой антибактериальной и противовоспалительной терапии. Дегенеративные изменения в миоматозных узлах, закономерно возникающие в процессе развития опухоли, часто обнаруживаемые с помощью разнообразной визуализации дополнительных методов исследования (УЗИ, МРТ, КТ) и не имеющие указанной выше симптоматики, не являются показанием к хирургическому лечению. Множественная миома матки небольших размеров, не приводящая к возникновению симптоматики, также не является показанием к операции. В некоторых национальных рекомендациях (ACOG Pract.Bull. №96, 2008) оспаривается необходимость проведения хирургического лечения только на основании клинически диагностированного быстрого роста опухоли вне периода постменопаузы (В).
Объем хирургического лечения
Больная с миомой матки, которой показана операция, должна иметь полную информацию о преимуществах и недостатках радикального и органосохраняющего объема хирургического лечения. Окончательное решение об объеме операции и доступе должна принимать сама пациентка совместно с хирургом (лечащий врач), подписывая информированное согласие на операцию и осведомление о возможности осложнений.
Гистерэктомия. Единственным, приводящим к полному излечению (радикальным) способом хирургического лечения является операция в объеме тотальной гистерэктомии – экстирпация матки (уровень доказательности IA). Субтотальная гистерэктомия (надвлагалищная ампутация матки) не является полностью радикальным вмешательством, но ее можно выполнять после подтверждения состояния шейки матки (кольпоскопия, биопсия при показаниях) (уровень доказательности IA). При сочетании с аденомиозом, учитывая отсутствие четкой границы заболевания, надвлагалищная ампутация не рекомендуется, так как возможно неполное удаление указанных выше патологических процессов, что в дальнейшем может быть причиной ещё одной операции (удаление культи шейки матки и других тазовых органов – дистального отдела мочеточника), так как это более сложное вмешательство в связи с развитием спаечно-рубцовых процессов с вовлечением мочевого пузыря. И хотя рецидивы миомы в культе шейки матки возникают редко, у 15-20% больных после операции этого объема наблюдают циклические кровянистые выделения из половых путей, что указывает на неполное удаление тканей миометрия и эндометрия. Тотальный объем гистерэктомии обеспечивает не только радикальное излечение при миоме матки, но и профилактику возникновения в будущем какого-либо заболевания шейки матки. В странах, не имеющих сплошного цитологического скрининга, тотальную гистерэктомию следует расценивать как одну из мер профилактики рака шейки матки. Гипотетические предположения о преимуществах субтотальной гистерэктомии по сравнению с тотальной в отношении отрицательного воздействия на функцию мочевыводящих путей, сексуальную функцию и влияние на качество жизни в целом не нашли подтверждения в многочисленных многоцентровых рандомизированных исследованиях. По мнению Американского конгресса акушеров-гинекологов (ACOG Comm.Opin.№388, 2007) субтотальный объем гистерэктомии не следует рекомендовать как наилучший при удаления матки при доброкачественных заболеваниях. Больную необходимо информировать об отсутствии научно доказанных различий между тотальной и субтотальной гистерэктомией в их влиянии на сексуальную функцию, а также о возможном рецидивировании миомы и возникновении других доброкачественных и злокачественных заболеваний в культе шейки матки, для лечения которых в будущем необходимо хирургическое лечение.
Доступ операции
Данные современной доказательной медицины свидетельствуют о том, что наилучшим оперативным доступом для удаления матки является влагалищный доступ. Для влагалищной гистерэктомии характерны меньшая длительность, кровопотеря и частота интра- и послеоперационных осложнений. Однако для использования этого доступа при миоме матки необходим ряд условий: достаточная ёмкость влагалища и подвижность матки, небольшая величина и масса опухоли (менее 16 нед. и 700 г), отсутствие выраженного спаечного процесса в полости таза и необходимости сочетанных операций на придатках матки и/или органах брюшной полости. При отсутствии условий для выполнения влагалищной гистерэктомии следует проводить лапароскопическую гистерэктомию. Лапаротомическая гистерэктомия, не имеющая каких-либо преимуществ по сравнению с лапароскопическим и влагалищным аналогом, необходима лишь небольшому числу больных с опухолями чрезвычайно больших размеров (более 24 нед. и 1500 г) или при противопоказаниях проведения анестезиологического пособия. Лапаротомическую гистерэктомию также можно проводить при отсутствии технических возможностей и условий для проведения эндоскопической операции (оснащения, хирургической бригады). Указанные выше границы величины и массы матки при ее удалении влагалищным или лапароскопическим доступом условны и зависят от опыта каждого конкретного хирурга. Вне зависимости от доступа при тотальной гистерэктомии следует использовать интрафасциальную технику, позволяющую максимально сохранить интеграцию между тазовой фасцией и поддерживающим связочным аппаратом матки.
Миомэктомия
Несмотря на то, что тотальная гистерэктомия является радикальной операцией, ее не следует рекомендовать женщинам молодого возраста, а также тем, кто желает сохранить матку и/или репродуктивную функцию. При наличии показаний к хирургическому лечению этим категориям больных выполняют органосохраняющие операции – миомэктомии. Показанием к миомэктомии является также бесплодие или невынашивание беременности при отсутствии каких-либо других причин кроме миомы матки. Взаимосвязь между миомой матки и бесплодием точно не определена. Однако результаты ряда исследований с высоким уровнем доказательности показали, что миоматозные узлы, контактирующие с полостью матки, могут быть причиной бесплодия. Имеются сведения об улучшении результатов ВРТ после миомэктомии у женщин с неуточненным бесплодием. На сегодняшний день ни один из существующих методов диагностики не может выявить все патологические очаги ни до операции, ни в ее процессе. Риск рецидивирования (возможно в большинстве случаев – персистенции) выше при наличии множественных миом. При единичном узле он составляет 27%, риск повторной операции, связанной с рецидивом, – 11%, а при множественных узлах – соответственно 59 и 26%.
Доступ операции
Выбор доступа миомэктомии – достаточно сложная задача, зависящая не только от объективных факторов, таких как размеры опухоли, ее локализация, множественность патологических изменений, но и от опыта конкретного хирурга.
Подслизистые миоматозные узлы (0-11 типа ESGE), не превышающие 5-6 см в диаметре, удаляют гистероскопически с помощью моно- или биполярного резектоскопа или внутриматочного морцеллятора. При технической невозможности полного удаления узла II типа показана двухэтапная операция. В течение 3-месячного перерыва между этапами больной назначают терапию аГнРГ, способствующую уменьшению матки и миграции неудаленных остатков узла в полость матки. Гистероскопическая миомэктомия может быть альтернативой гистерэктомии у женщин в постменопаузе, у которых вследствие сокращения матки миоматозные узлы, расположенные рядом с полостью, мигрируют в неё. У женщин пременопаузального возраста, не заинтересованных в сохранении репродуктивной функции, гистероскопическую миомэктомию целесообразно сочетать с резекцией эндометрия.
Больным с единичными миоматозными узлами субсерозной и интерстициальной локализации, даже при значительных их размерах (до 20 см) целесообразно проводить лапароскопическую миомэктомию. Указанный максимальный диаметр узла является условным пределом, особенно при его субсерозном расположении. Того же подхода к выбору доступа следует придерживаться при наличии множественных субсерозных миом. Во всех случаях рану на матке необходимо зашивать послойно, так же как при влагалищной или лапаротомической миомэктомии. Следует использовать экстракорпоральную технику завязывания узлов, которая обеспечивает достаточную степень натяжения нити и полноценное сопоставление краев раны. Лапароскопическую миомэктомию можно сочетать с гистероскопической у больных с ассоциацией субсерозных и субмукозных узлов.
Недостатками лапароскопического доступа являются отсутствие возможности пальпаторного поиска межмышечных узлов и их энуклеации с помощью дополнительных разрезов миометрия в ложе основного узла. При множественных интерстициальных миомах или ассоциациях множественных узлов различных локализаций целесообразно проводить лапаротомическую миомэктомию.
Во всех случаях рождающихся или родившихся подслизистых опухолей миомэктомию проводят влагалищным доступом. При наличии единичных субсерозных и межмышечных узлов, располагающихся на задней стенке матки или в ее дне, можно выполнить миомэктомию влагалищным доступом через заднее кольпотомное отверстие. Таким способом можно удалять миомы до 8-12 см в диаметре, используя технику фрагментации узлов. Влагалищный доступ является наиболее подходящим для миом, локализующихся частично или целиком во влагалищной части шейки матки.
Вспомогательные хирургические технологии
Одна из основных проблем миомэктомии – борьба с интраоперационным кровотечением. Для уменьшения кровопотери используют как сосудосуживающие агенты (вазопрессин), так и разнообразные способы механической окклюзии сосудов, снабжающих матку (жгуты, зажимы, перевязка, коагуляция или эмболизация маточных артерий). В некоторых странах сосудосуживающие средства запрещены вследствие имеющихся сведений о фатальных осложнениях сердечно-сосудистой системы после местного применения этих препаратов. В любом случае при применении указанных препаратов необходимо предупредить анестезиолога, учитывая сосудистый эффект к повышению АД.
Вторая важная проблема миомэктомии – возникновение послеоперационного спаечного процесса. На сегодняшний день наиболее успешными способами профилактики спаек считают барьерные способы (сетки, гели, растворы), обеспечивающие временное отграничение раны от прилежащих к ней анатомических структур.
Новым являются доказанное применение кондиционирования брюшной полости во время эндоскопической операции с контролируемым режимом температуры, влажности и дополнительное использование кислорода.
Послеоперационное ведение
После тотальной гистерэктомии единственным ограничением для пациентки является отказ от половой жизни в течение 1,5-2 мес. Больным после субтотальных гистерэктомий следует регулярно проводить цитологическое исследование шеечного эпителия.
Пациентки после миомэктомии должны предохраняться от беременности в течение 6-12 мес. в зависимости от глубины повреждения стенки матки при операции. Наиболее подходящим способом предохранения следует признать оральные контрацептивы. Беременеть разрешается через 1 год.
Послеоперационное противорецидивное лечение аГнРГ не показано, так как оно снижает кровоснабжение матки и, следовательно, ухудшает заживление раны.
Вопрос о несостоятельности рубца на матке после эндоскопических миомэктомий, поднимающийся в современной отечественной литературе, требует тщательного анализа. В зарубежной литературе существует только одна работа, в которой проанализированы 19 случаев разрыва матки в срок от 17 до 40 нед. беременности после миомэктомии с 1992 по 2004 г. Только в 3 случаях (18%) узлы миомы были больше 5 см в диаметре, а в 12 случаях (63%) не превышали 4 см в диаметре. Гемостаз раны только в 2 случаях (10%) осуществляли без коагуляции. В 7 (37%) рану не зашивали. Ни одна из женщин не умерла, 3 плода (18%) на 17-й, 28-й и 33-й неделе гестации погибли. Существует только 2 сообщения о случаях разрывах матки при беременности после гистероскопических миомэктомий.
Кроме того, причиной послеоперационных кровотечений могут быть проблемы свертывающей системы крови, например, болезнь Виллебранда. Их можно остановить эмболизацией маточных артерий. Впервые эмболизацию маточных артерий и сосудистых коллатералей в акушерско-гинекологической практике применили во ВНИЦ ОЗМиР М3 СССР в 1984 г. (Л.В. Адамян).
С конца 70-х годов рентгенэндоваскулярную эмболизацию маточных артерий используют в акушерской и гинекологической практике:
- для остановки кровотечения в послеродовом периоде;
- при пузырном заносе;
- после кесарева сечения;
- для консервативной миомэктомии и гистерэктомии;
- для остановки кровотечения при неоперабельных злокачественных новообразованиях;
- для предоперационной деваскуляризации сосудистых опухолей и артериовенозных аномалий с целью облегчения их удаления и уменьшения кровопотери.
Эмболизация маточных артерий в лечении миомы матки
В настоящее время перспективным рентгенохирургическим вмешательством при лечении миом является эндоваскулярная эмболизация маточных артерий.
Многие больные в категоричной форме отказываются от хирургического или гормонального лечения, что обусловлено психоэмоциональным статусом пациентки или желанием сохранения собственной репродуктивной функции.
В течение последнего десятилетия эмболизация маточных артерий как самостоятельный метод лечения миомы матки вызывает особый интерес. Миниинвазивность эндоваскулярного вмешательства, проводимого под местной анестезией, эффективность метода, приводящего к уменьшению или исчезновению симптомов миомы матки, сохранение репродуктивной функции женщины, короткий срок госпитализации — важные и определяющие факторы для самих пациенток.
Показания к эмболизации маточных артерий, симптомная миома матки. Эмболизация маточных артерий (ЭМА) является альтернативой хирургическому лечению (уровень доказательности В).
Противопоказания к эмболизации маточных артерий: беременность, воспалительные заболевания органов малого таза в стадии обострения, аллергические реакции на контрастное вещество, артериовенозные пороки развития, недифференцированное опухолевидное образование в малом тазу, подозрение на лейомиосаркому.
Инструментальные и лабораторные исследования перед процедурой включают все те, которые приняты для планового хирургического лечения, в том числе:
- бактериоскопическое исследование микрофлоры влагалища (при выявлении воспалительных изменений необходимо провести антибактериальную терапию – возможно местное применение, с целью уменьшения воспалительных осложнений ЭМА) (уровень доказательности В);
- онкоцитологическое исследование эндо- и экзоцервикса;
- ультразвуковое исследование органов и сосудов малого таза с определением скорости кровотока по маточным, яичниковым артериям и их ветвям. Для оценки параметров кровотока по сосудам матки используют ультразвуковое триплексное ангиосканирование (УЗАС), включающее сканирование сосудов в В-режиме, допплерографию и цветное допплеровское картирование кровотока;
- гистероскопия и раздельное диагностическое выскабливание, с последующим патогистологическим исследованием – при дисфункции яичников, увеличении срединного м-эха, не соответствующего дню менструального цикла;
- консультация гинеколога, интервенционного рентгенолога. ЭМА должны проводить опытные интервенционные рентгенологи, знакомые с техникой проведения процедуры, а также особенностями кровоснабжения миоматозных узлов (уровень доказательности С);
- при выявлении опухоли яичника или одного из узлов при множественном характере роста субсерозного типа на тонком основании проводят оперативную лапароскопию – удаление образования яичника до ЭМА, с последующим патогистологическим исследованием, а удаление миоматозного узла – после ЭМА с целью снижения объема кровопотери и риска «отшнуровывания» узла в брюшную полость.
Особые случаи
При субмукозном расположении узла ЭМА показана в том случае, когда резектоскопия невозможна и нецелесообразна.
При больших размерах интерстициальных и интерстициально-субсерозных узлах рекомендовано лечение миомы матки в 2 этапа: на первом этапе показана ЭМА с последующим хирургическим лечением, решение о проведении второго этапа принимают индивидуально (уровень доказательности С).
ЭМА необходимо проводить в условиях стационара, так как у 80-90% пациенток развивается постэмболизационный синдром (ПЭС).
Техника выполнения ЭМА
Для эмболизации применяют частицы PVA (поливиниловый спирт) – суспензионное искусственное эмболизирующее вещество, используемое для окклюзии или снижения кровотока в гиперваскуляризированных или неопластических образованиях введением его в просвет сосуда при селективной и суперселективной катетеризации. Суспензионный поливиниловый спирт PVA — это частицы разного размера: 45-150, 250-355, 355-500, 500-710, 710-1000, 1000-1400, 1400-2000 мкм. Наиболее часто при ЭМА используют частицы PVA размером от 250 до 710 мкм.
Перед эмболизацией выполняют обзорную тазовую артериографию, селективную артериографию маточных артерий для определения ангиоархитектоники кровоснабжения миоматозного узла. По результатам исследования оценивают возможность проведения эмболизации и значимость коллатерального кровотока.
Через интродьюсер или проводниковый катетер 5-6 F по проводнику вводят микрокатетр 3 F с гибкой и уменьшенной до 2,4 F дистальной частью. Катетер проводят в дистальный сегмент маточной артерии. После выбора эмболизирующих частиц PVA соответствующего размера содержимое флакона с частицами разводят 3-5 мл рентгеноконтрастного вещества (омнипак 350, ультравист 370). После размешивания и встряхивания содержимого флакона шприцем быстро форсированно вводят растворенные частицы PVA с контрастным веществом через катетер за 1-3 с последующим подтягиванием конца катетера на себя для предупреждения фиксирования катетера с эмболизирующим веществом и стенкой маточной артерии.
Через 3-5 мин проводят контрольную селективную артериографию через этот же катетер.
ЭМА на сегодняшний день — малоинвазивный метод лечения миомы матки. Эффективность данного рентгенохирургического вмешательства не вызывает сомнений, что позволяет более широко его использовать во всем мире. Особую актуальность ЭМА приобретает для лечения пациенток, категорически отказывающихся от любого вида хирургического лечения, и женщин с высоким риском традиционного или гормонального лечения.
При этом необходимо информировать больную о возможном развитии осложнений и рецидивов, а также иметь ее информированное согласие на проведение рентгенохирургического вмешательства (эмболизация маточных артерий).
ЭМА ни в коем случае не исключает медикаментозное лечение или традиционное оперативное вмешательство (гистерэктомия, миомэктомия). Напротив, в некоторых случаях данные методы лечения дополняют друг друга, и ЭМА может быть первым этапом, значительно уменьшающим риск интраоперационной кровопотери и исключающим необходимость гемотрансфузий, перед традиционными оперативными вмешательствами.
Необходимо отметить, что с развитием новых технологий появилась возможность использовать опыт врачей других специальностей для лечения различных гинекологических заболеваний, в том числе и миомы матки.
Постэмболизационный синдром
Пациенткам, перенесшим ЭМА, для самооценки болевого синдрома предлагают визуально-цифровую шкалу (от 0 до 10 баллов):
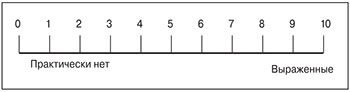
В постэмболизационном периоде при I (легкой) степени выраженности (до 7 баллов) рекомендуют анальгетики и спазмолитики (анальгин 50% – 2,0, в/м; баралгин 5,0, в/м), неспецифические нестероидные противовоспалительные препараты (ортофен 3,0, в/м) однократно (уровень доказательности С).
При II (средней) степени выраженности (от 8 до 14 баллов) необходимы назначение обезболивающей терапии (трамал 2,0, в/м; кеторол 2,0, в/м); проведение инфузионной терапии кристаллоидами (изотонический раствор NaCl 0,9%-400,0, в/в; трисоль 400,0, в/в; раствор Хартмана 400,0, в/в – в объеме 800-1200 мл); внутримышечное введение антибактериальных препаратов: цефалоспорины, фторхинолоны (цефазолин 1,0×2 р/д; ципрофлоксацин 1,0×3 р/д), противовоспалительных препаратов (ортофен 3,0, в/м); нормализация функции ЖКТ – церукал 2,0, в/м; катетеризация мочевого пузыря – при задержке мочеиспускания (уровень доказательности С).
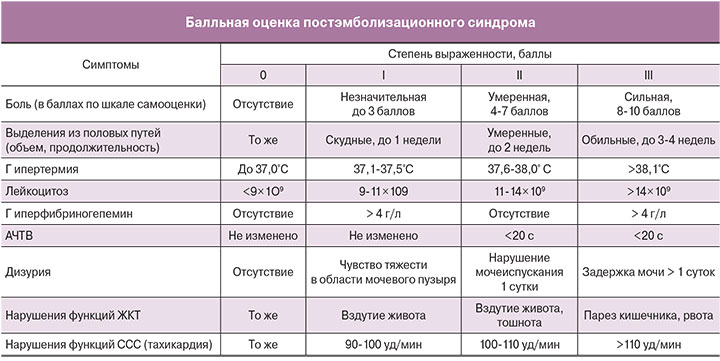
При III степени (тяжелый ПЭС) (15-21 балл) необходимы неоднократное назначение наркотических анальгетиков опиоидного ряда (промедол 2%-1 мл, в/м; омнапон 2%-1 мл, в/м); курс инфузионной терапии (изотонический раствор NaCl 0,9% - 400,0, в/в; трисоль 400,0, в/в; раствор Хартмана 400,0, в/в) и дезинтоксикационной терапии (гемодез 400,0) – в объеме 1200-2000 мл; внутривенное введение антибактериальных препаратов (ципрофлоксацин 100,0×2 р/д, метрогил 100,0×2 р/д); коррекция реологических свойств крови, гемостаза (реополиглюкин 400,0, в/в), препаратов, благоприятно воздействующих на перистальтику, нормализующих функцию кишечника; в/в назначение противорвотных препаратов; катетеризация мочевого пузыря катетером Foley (уровень доказательности С).
Сроки пребывания в стационаре составляют от 1 до 12 койко-дней, в среднем – 3-5 (уровень доказательности С).
Наблюдаемые изменения узлов после ЭМА (уровень доказательности С):
- уменьшение объема узлов на 50-60%;
- миграция;
- размягчение;
- экспульсия узлов.
В отдельных случаях необходимо удалить субмукозные или субсерозные узлы (второй этап – хирургическое), в таком случае прибегают к трансвагинальной или лапароскопической миомэктомии.
ЭМА малоэффективна при (уровень доказательности С):
- шеечно-перешеечном расположении узлов (необходимо проведение дополнительного ангиосканирования для выяснения всех источников кровоснабжения узлов);
- «бедном» кровоснабжении миом (ИР выше 0,6);
- сочетании миомы матки с диффузной формой аденомиоза.
Репродуктивные функции и ЭМА:
Проведение ЭМА для пациенток, которые желают впоследствии забеременеть и сохранить свою репродуктивную функцию возможно (уровень доказательности В).
По данным систематического обзора Кохрановского сообщества (2012 г.) при сравнении фертильности у больных с миомой матки после ЭМА и консервативной миомэктомии количество наступивших беременностей и родов сопоставимы – при ЭМА OR 0,33, 95% CI 0,11, миомэктомии OR 0,29, 95% CI 0,10 [Uterine artery embolization for symptomatic uterine fibroids (Review) /2012/ The Cochrane Collaboration. Published by John Wiley and Sons, Ltd].
При недавнем проспективном исследовании установлено, что ЭМА, проведенная сразу после кесарева сечения, у женщин с миомой матки может быть эффективной мерой в снижении послеродовой кровопотери и сводить к минимуму риск миомэктомии или гистерэктомии.
Есть несколько сообщений об успешных, без осложнений, беременностях после ЭМА.
ЭМА во время беременности, перед родами или при ангиодисплазиях таза и других рисках кровотечения можно проводить при предлежании плаценты.
Технология MRgFUS
MRgFUS (или MRgHIFU) – это технология неинвазивной деструкции тканей высокоинтенсивным сфокусированным ультразвуком под контролем магнитно- резонансной томографии. Процедура выполняется на специальной установке, генерирующей высокоинтенсивный ультразвук, объединенной в единую систему с высокопольным магнитно-резонансным томографом. Высокоинтенсивный сфокусированный ультразвук является лечебным агентом. МР-томография служит средством контроля, навигации и термометрии в режиме реального времени. В результате короткого (несколько секунд) дистанционного воздействия энергии ультразвука, сфокусированного в прицельном, посредством МР-навигации, патологическом участке внутри организма, ткань, которая находится в фокусе US- луча, нагревается до температуры, необходимой для её термической деструкции, но при этом ткани, окружающие фокус, остаются интактными. По сути, технология MRgFUS удовлетворяет принципам идеального хирургического инструмента.
Первая система для клинического применения MRgFUS создана в 1999 году. В 2004 году, на основании многоцентрового исследования, получено одобрение FDA. Российской Федеральной службой по надзору в сфере здравоохранения и социального развития система зарегистрирована в 2004 году (ФС№2004/1389). В 2009 году в России зарегистрирована технология органосберегающего лечения миом матки сфокусированным ультразвуком (ФС№2009/372).
MRgFUS в лечении миомы матки
Технология MRgFUS имеет ряд преимуществ по сравнению с другими методами органосберегающего лечения миомы матки, поскольку является неинвазивной, не оказывает клинически значимого общего действия на организм, представляет собой амбулаторную процедуру, не требует периода реабилитации и временной нетрудоспособности. Однако метод имеет ряд ограничений, обусловленных гистологическим строением миом и топографо-анатомическими взаимоотношениями в зоне лечебного интереса. При этом технология MRgFUS, примененная в оптимальных условиях, демонстрирует в 85 – 90% случаях клинический эффект и длительную ремиссию. Метод эффективен при лечении типичных миом матки и неэффективен при «клеточных» миомах и узлах с деструктивными изменениями (уровень доказательности В).
Патогенез местных и клинических эффектов
FUS-воздействия на миому
Оптимальным гистологическим типом миомы матки MRgFUS терапии являются типичные миомы, т.е. миомы с преобладанием соединительно-тканного компонента, без или с минимальными вторичными изменениями. В ткани типичной миомы в результате MRgFUS терапии миоциты и строма «трансформируются» в ткань в состоянии тотального сухого коагуляционного некроза и, впоследствии, развивается фиброз. В итоге, узел становится аваскулярным, останавливается рост, происходит постепенный регресс узла и соответственно симптомов миомы матки. Регресс симптомов в меньшей степени связан с уменьшением объема узлов, в большей степени с изменением их тканевой структуры. Стабильность ремиссии определяется соотношением действительного объема деструкции к объему интактной зоны узла и типом некроза (сухой или влажный). В последующем рост узла может происходить в связи с продолженным ростом зон, не подвергшихся FUS воздействию.
В миомах с преобладанием клеточного компонента содержания соединительной ткани недостаточно для поддержания температуры (55-85°С) столько времени, сколько это необходимо для формирования тотального сухого коагуляционного некроза. Зоны «некроза» представляют собой кольцевидные геморрагические инсульты, локализованные в соединительно-тканной строме, внутри и вокруг которых неповрежденная ткань миомы. В последующем происходит либо полное восстановление, либо трансформация в зону влажного некроза.
При наличии в миоматозных узлах значительного отека стромы не зависимо от их основного гистологического строения в ткани миомы нет субстрата, способного задерживать и поглощать энергию FUS.
При наличии выраженных спонтанных деструктивных изменений в миоме (более 30 %) не зависимо от их основного гистологического строения теряется клинический смысл процедуры MRgFUS деструкции.
Показания к проведению MRgFUS терапии миомы матки
MRgFUS терапия рекомендуется: при наличии стандартных показаний к лечению симптомной миомы матки, с целью подготовки узлов к хирургическому удалению (особенно к трансцервикальной миомэктомии) и для профилактики клинических проявлений миомы матки. При этом обязательным условием является отсутствие противопоказаний к органосберегающему лечению, отсутствие противопоказаний к проведению МР-томографии, а также наличие условий для эффективного проведения MRgFUS терапии. В исключительных случаях процедура MRgFUS оправдана при необходимости временно отсрочить хирургическое лечение.
Противопоказания к проведению MRgFUS терапии миомы матки.
- Противопоказания, обусловленные состоянием органов гениталий.
- Противопоказания, обусловленные общим состоянием пациентки.
- Противопоказания, обусловленные техническими ограничениями системы для проведения MRgFUS терапии.
Противопоказания, обусловленные состоянием органов гениталий:
Абсолютные
- Наличие противопоказаний к органосберегающему лечению.
- Острый воспалительный процесс органов гениталий.
- Беременность.
Относительные
- Миома матки не является основным заболеванием и основной причиной клинических симптомов.
- Тубоовариальные воспалительные образования вне обострения.
- Доброкачественные опухоли и опухолевидные образования яичников.
Противопоказания, обусловленные общим состоянием пациентки:
- Заболевания печени: циррозы печени в активной фазе с мезенхимально-воспалительным или цитолитическим синдромом, явлениями портальной гипертензии; вирусные гепатиты с признаками репликативной активности; стеатогепатиты в активной фазе.
- Заболевания почек с нарушением азотвыделительной функции.
- Заболевания сердечно-сосудистой системы, сопровождающиеся нарушениями ритма и признаками недостаточности кровообращения.
- Аллергические заболевания: бронхиальная астма; рецидивы отека Квинке (крапивницы); поллинозы (аллергический ринит, коньюктивит).
Противопоказания, обусловленные ограничениями системы MRsFUS.
— Противопоказания, обусловлены ограничениями метода МРТ:
- Наличие металлических и магнитных имплантов,
- Наличие кардиостимулятора,
- Вес более 110 кг,
- Окружность талии более 110 см,
- Боязнь замкнутого пространства.
— Противопоказания, обусловлены ограничениями FUS:
- Грубые и обширные рубцы передней брюшной стенки,
- Липосакция области живота в анамнезе,
- Пластика передней брюшной стенки полимерной сеткой в анамнезе,
- Рентгеноэндоваскулярная окклюзия маточных сосудов в анамнезе,
- Наличие внутриматочного контрацептива.
Условия, необходимые для эффективного проведения MRgFUS терапии:
- Способность миомы адекватно поглощать энергию FUS.
- Достаточные размеры лечебного акустического окна.
- Доступность всех отделов миомы для луча FUS.
Оптимальным методом визуальной диагностики, позволяющим объективно оценить морфологические и топографо-анатомические условия, необходимые для эффективной MRgFUS терапии, является МР-томография.
Критерии миомы матки оптимальной для MRgFUS терапии:
- МР-тип «черная» (гистологический тип: типичная миома без отека стромы),
- размеры узлов от 20 см до 80 мм в диаметре,
- количество узлов менее трех,
- интерстициальный компонент узла более 30%,
- доступность для FUS всех отделов узла.
Приемы, позволяющие улучшить условия проведения MRgFUS терапии при неполном соответствии миомы матки критериям «оптимальной»:
Методы дегидратации узлов миомы:
- неинвазивный лимфодренаж,
- в/м введение сульфата магния.
Методы обеспечения доступа FUS к узлам миомы:
- тугое тампонирование влагалища,
- использование МР-совместимого маточного манипулятора,
- наполнение мочевого пузыря,
- введение ректального баллона,
- висцеральный массаж снизу вверх нижней половины живота,
- принятие на 10-15 мин колено-локтевого положения,
- плотное «замазывание» рубца УЗ-проводящим гелем.
Тактические варианты MRgFUS терапии миом матки
В зависимости от клинических задач, которые определяет врач-гинеколог, технология MRgFUS в лечении миомы матки может быть использована по четырем основным тактическим вариантам:
- Профилактика клинических проявлений миомы матки.
- Органосберегающее лечение симптомной миомы матки.
- Подготовка узла миомы матки к трансцервикальному удалению.
- Необходимость отсрочить оперативное лечение.
В зависимости от соответствия узлов миомы матки основным морфологическим и топографо-анатомическим условиям клинически эффективного проведения процедуры, которые определяются на основании визуальных данных комплексной МР-томографии, каждый из четырех вариантов тактического использования метода MRgFUS может быть выполнен по двум протоколам:
- Стандартный протокол (без применения вспомогательных методик).
- Нестандартный протокол (с применением вспомогательных методик, обеспечивающих морфологические и топографо-анатомические условия клинически эффективного проведения процедуры).
Алгоритм направления на MRgFUS терапию миомы матки
Ответственным за выбор метода органосберегающего лечения, в частности, за выбор MRgFUS терапии, является врач гинеколог.
Задачи первого этапа:
Уточнить наличие показаний к лечению миомы матки, или проведению профилактики возможных ее осложнений, исключить наличие противопоказаний к органосберегающему лечению и MRgFUS терапии.
Задачи второго этапа:
Уточнить наличие морфологических и топографо-анатомических условий для клинически эффективного проведения MRgFUS терапии миомы матки.
Метод исследования:
Магнитно-резонансная томография в положении пациентки «лежа на животе», при необходимости с введением контрастирующего агента, или использовании других режимов (в т.ч. МР-спектроскопии).
Задачи третьего этапа:
Уточнить целесообразность MRgFUS терапии, с какой целью, по какому тактическому варианту и протоколу может быть использована методика в данном клиническом случае.
Оформить результаты комплексной диагностики в виде письменного заключения. В заключении необходимо указать планируемый тактический вариант и протокол MRgFUS терапии, планируемые для FUS деструкции узлы, их МР-тип (гистологический тип), возможные технические трудности и рекомендуемые мероприятия.
Подготовка пациенток к MRgFUS терапии миомы матки
Госпитализация для выполнения процедуры MRgFUS терапии миомы матки не требуется. В день процедуры, пациентка проводит тест для исключения беременности.
Оптимальное время проведения MRgFUS терапии миомы матки: середина менструального цикла.
Специальная подготовка накануне процедуры не проводится. Исключение составляют пациентки, которым необходима дегидратация узлов: в этих случаях в течение 2-5 дней проводится лимфодренаж в сочетании с в/м введением сульфата магния. Накануне не рекомендуется употреблять продукты, дающие усиление перистальтики и повышенное газообразование. В день процедуры пациентка может принять легкую пищу и питье.
С целью профилактики ожога передней брюшной стенки: у пациентки должен быть побрит лобок.
Пациентка обязательно подписывает «Информированное согласие» на выполнение процедуры MRgFUS терапии миомы матки по конкретному тактическому варианту и протоколу.
MRgFUS терапия миомы матки проводится без наркоза. Для предотвращения непроизвольных движений тела во время длительной процедуры пациенткам могут быть назначены седативные препараты.
Возможные осложнения MRgFUS терапии миомы матки
Системы для проведения MRgFUS терапии предполагают высокую безопасность при условии соблюдения соответствующих правил. На сегодняшний день выполнено более 10000 процедур MRgFUS терапии. Международный анализ свидетельствует, что осложнения при проведении MRgFUS терапии возникают крайне редко и являются следствием невнимательности врача в ходе выполнения процедуры, нарушениями протоколов и несоблюдением критериев отбора пациенток. Отсутствие клинического эффекта от MRgFUS терапии – осложнением процедуры не считается.
Возможные осложнения MRgFUS терапии миомы матки:
- Локальный ожог и локальный термический отек передней брюшной стенки.
- Нейропатия седалищных нервов (и дискомфорт в указанной области).
- Термическое повреждение органов малого таза.
- Свищ между миоматозным узлом и полостью матки.
Локальный ожог передней брюшной стенки, как осложнение MRgFUS терапии, описан в исследовании для FDA (3 наблюдениях). Причины: нагрев послеоперационных рубцов, перепад акустических сред при наличии пузырьков воздуха на волосах на пути FUS, отражение FUS от кальцинатов в узле миомы. В результате были разработаны эффективные меры профилактики.
Нейропатия седалищных нервов, как осложнение MRgFUS терапии, которая потребовала медикаментозного лечения в течение 1.5 месяцев, также описана в исследовании для FDA (2 наблюдения). Причина: нагрев седалищных нервов и крестцового сплетения в ходе выполнения процедуры. Профилактика – соблюдение безопасного расстояния до крестца 4 см. Временный дискомфорт в поясничной области, не требующий медикаментозной коррекции, возможен при проведении процедуры более 5-6 часов (при лечении многоузловых миом). Причина: длительное нахождение пациенток в вынужденном положении «лежа на животе».
Локальное термическое повреждение (диаметром 0.5см) тонкой кишки при проведении MRgFUS терапии миомы матки (имеются сообщения о 3-х случаях). Причина: многократное прохождение FUS через один и тот же участок петли тонкой кишки. Меры профилактики: соблюдение правил выполнения процедуры.
Образование свища между узлом миомы и полостью матки с отхождением FUS-детрита может иметь место при MRgFUS терапии крупных миом, локализованных близко к подслизистому слою матки у пациенток с осложнёнными выскабливаниями в анамнезе и NPV 80-90% (1 наблюдение).
При возникновении подобного осложнения эффективно выполнение вакуум-аспирации некротических масс через свищевой ход под контролем гистероскопии в сочетании со стандартной антибактериальной, противовоспалительной и инфузионной терапией.
Ведение пациенток после MRgFUS терапии миомы матки
В специальном наблюдении, после выполнения MRgFUS терапии миомы матки, пациентки не нуждаются, могут быть отпущены домой и вернуться к своей обычной профессиональной деятельности сразу после процедуры. Контроль показателей крови и температуры, использование обезболивающих препаратов, назначение специальной диеты и режима не требуется.
Для оценки клинической эффективности MRgFUS терапии пациенткам должен быть предложен план наблюдения, в который включаются исследования, на основании которых можно объективно судить о динамике основных симптомов миомы матки, изменении качества жизни и длительности ремиссии.
План наблюдения после MRgFUS терапии миомы матки:
Рекомендуемые визиты через 1,3,6, 12 и 24 месяцев.
Детализированное УЗ-исследование.
МР-исследование с контрастированием.
Оценка интенсивности маточных кровотечений (РВАС, Higham, Janssen).
Оценка интенсивности тазовой боли (Short-Form McGill Pain Questionnaire).
Оценка качества жизни (UFS-QoL).
Оценка длительности ремиссии.
Основная задача детализированного ультразвукового исследования – мониторинг последующих за MRgFUS терапией изменений в миоматозных узлах, подвергнутых FUS-деструкции, а также оценка состояния матки и придатков. В ходе исследования отмечаются: размеры матки в целом и размеры миоматозных узлов, подвергнутых FUS; структурные изменения миоматозных узлов после FUS- воздействия; кровоток в миоматозных узлах и его изменения после проведения MRgFUS терапии; кровоток вокруг миоматозных узлов, подвергнутых FUS; состояние миометрия и его кровоснабжение; состояние эндометрия, яичников и окружающих гениталии тканей.
Основная задача комплексного МР-исследования — объективная визуализация динамики тканевой структуры и объёма узлов, подвергнутых MRgFUS терапии, динамики объёма и «поведения» аваскулярной зоны (NPV), динамики объема и тканевой структуры узлов, не подвергнутых MRgFUS терапии, а также выявление новых узлов.
Состояние и динамика основных симптомов миомы матки и качества жизни оцениваются на основании подсчета баллов соответствующих анкет и шкал. При наступлении ремиссии – отмечается ее длительность.
Полученные результаты динамического наблюдения (МР-томограммы, данные УЗИ, количество баллов) анализирует и определяет дальнейшие рекомендации – врач акушер-гинеколог. Заключение оформляется в виде протокола контроля результатов MRgFUS терапии миомы матки. В протоколе кроме стандартных клинических данных (диагноз, дата выполнения MRgFUS терапии, МР-тип миомы, размеры миомы), указываются бальная оценка симптомов миомы, динамика объема узлов, состояние кровотока в узлах по данным МРТ и детализированного УЗИ, факт появления новых узлов. При оценке результатов MRgFUS терапии и определении последующих рекомендаций обязательно учитывается тактический вариант процедуры.
При рецидивах роста миомы матки, возврате симптомов заболевания и при отсутствии соответствующих противопоказаний может быть проведена повторная MRgFUS терапии. Для лечения миомы матки ограничений в повторных процедурах MRgFUS нет. Необходимость очередной MRgFUS терапии определяется врачом гинекологом с позиций клинической целесообразности.
6.2. МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Миому матки диагностируют у 77% женщин репродуктивного возраста, при этом разнообразные симптомы, сопряженные с этим заболеванием зафиксированы только в 25% случаев. Таким образом, при бессимптомном течении миом, за исключением больших размеров опухолей, нет оснований для назначения лекарственных средств (уровень доказательности IA).
Наличие аномальных маточных кровотечений, анемии, боли в области малого таза и сопутствующих и гиперпластических процессов эндометрия является показанием к лечению – назначение медикаментозных средств либо хирургическое лечение. При этом следует понимать, что единственная цель медикаментозного лечения – облегчение или ликвидация симптомов, связанных с миомой матки, регресс миоматозных узлов (уровень доказательности С). К первой линии терапии симптомных миом относят медикаментозное лечение.
Согласно рекомендациям FDA, аГнРГ признаны единственным лекарственным средством, способным не только уменьшить симптоматику, обусловленную миомой матки, но и временно воздействовать на объем миоматозных узлов, при этом, к сожалению, продолжительность лечения ограничена 6 мес. в связи побочными эффектами (гипоэстрогения, потеря минеральной плотности костной ткани) и в основном его используют как метод предоперационной подготовки. После отмены терапии через 2-3 мес. объемы миоматозных узлов приближаются к исходным параметрам [http://www.fda.gov].
Из новых медикаментозных средств следует обратить внимание на улипристал, который в связи с химическими изоформами влияет на размер миоматозного узла (уменьшает), не оказывая при этом побочных гипоэстрогеновых эффектов. Большое положительное значение имеет остановка кровотечения, что особенно важно при анемии в связи с менометроррагией.
При выборе варианта медикаментозной терапии следует оценивать не только его эффективность, но и безопасность, переносимость, а также принимать во внимание экономическую рентабельность лечения. Проводимую медикаментозную терапию необходимо оценивать каждые 3 месяца, и при ее неэффективности следует назначать другие препараты.
Нестероидные противовоспалительные средства
Существующие в настоящее время нестероидные противовоспалительные средства (НПВС) относят к различным группам в зависимости от химической структуры, но они имеют единый механизм действия и сходный терапевтический эффект. В настоящее время наиболее широко используют ацетилсалициловую кислоту, диклофенак, ибупрофен, флурбипрофен, кетопрофен, напроксен, тиапрофеновую кислоту, индометацин, фенилбутазон, пироксикам, мелоксикам, целекоксиб.
В исследовании 2013 г. установлено, что экспрессия ЦОГ-2 значительно выше в миоме матки, чем в здоровых гладкомышечных клетках матки. НПВС снижают активность ЦОГ-2 и уровень простагландинов, содержание которых повышено у женщин с избыточной менструальной кровопотерей. Кроме того, они эффективны при дисменорее.
В систематическом обзоре Ассоциации Кохрана 2013 г. показано, что при миоме матки данные препараты могут уменьшить значительную менструальную кровопотерю, но менее эффективно, чем транексамовая кислота, даназол или ЛНГ-ВМС (уровень доказательности 1а). Установлено, что нет статистически значимых различий между эффективностью НПВС и другими препаратами (пероральные прогестагены, этамзилат, предыдущее поколение прогестерон-выделяющих ВМС, комбинированные оральные контрацептивы), однако большинство исследований имели низкую мощность. Нет данных о различиях между отдельными НПВС (напроксен и мефенамовая кислота) в снижении менструальной кровопотери.
НПВС эффективны при боли, связанной с асептическим некрозом лейомиомы (уровень доказательности На). У 2% беременных выявляют миому матки, из них 10% имеют осложнения, связанные с миомой во время беременности, такие как боль во II и начале III триместра и периодические кровянистые выделения. Короткие курсы ибупрофена успешно контролировали болевые ощущения в данных группах пациенток. Доказано, что индометацин может быть также эффективен в лечении боли, связанной с дегенерацией миомы матки во время беременности.
Таким образом, НПВС следует рекомендовать для лечения симптомов, связанных с миомой матки (уровень доказательности В).
Транексамовая кислота
В качестве негормональных препаратов 1-й линии при аномальных маточных кровотечениях применяют антифибринолитики, в частности транексамовую кислоту.
Транексамовая кислота – транексам – относят к синтетическим ингибиторам фибринолиза и вследствие структурного сходства с лизином способна по конкурентному типу блокировать процесс активации плазминогена, предупреждая лизис тромба в зоне повреждения сосуда, угнетать фибринолиз, оказывать системный гемостатический эффект при повышенной активности плазмы. Транексамовая кислота, являясь мощным фибринолитическим агентом, связывается с плазминогеном, тем самым предотвращая формирование плазмина и активацию фибринолиза.
По механизму действия транексамовая кислота подобна s-аминокапроновой кислоте, но превосходит ее по эффективности в 20-30 раз. Согласно рекомендациям FDA, оптимальная суточная доза составляет 3,9–4,0 г, длительность приема до 5 дней. Частота побочных эффектов при приеме транексамовой кислоты минимальна и они в основном проявляются легкой тошнотой, головной болью, заложенностью носа и болью в спине. Транексамовая кислота способствует снижению менструальной кровопотери на 40,4%.
Данные последнего плацебо-контролируемого исследования (III фаза) свидетельствуют о значительном снижении обильных менструальных кровотечений под действием транексамовой кислоты при миоме матки.
В систематическом обзоре Cochrane (2009) имеются данные о значительном снижении объема кровопотери при миомэктомии.
Учитывая основные механизмы действия, антифибринолитические препараты могут быть использованы для уменьшения объема кровопотери при миомах матки (уровень доказательности В).
Прогестагены
Прогестагены относят к стероидным гормонам. Их биологические эффекты обусловлены взаимодействием со стероидными рецепторами. Прогестагены оказывают как центральное действие, блокируя гипоталамо-гипофизарно-яичниковую ось, уменьшая при этом секрецию стероидных гормонов яичниками, так и непосредственное влияние на эндометрий, вызывая его децидуализацию и секреторную трансформацию эпителиальных клеток, приводя в конечном счете к его атрофии при использовании в непрерывном режиме. Прогестагены активируют фермент 17Р-гидростероид-дегидрогеназу типа 2, преобразующий эстрадиол в менее активный эстрон. Прогестагены оказывают ингибирующее влияние на синтез простагландина Е2.
Внутриматочный способ лечения прогестагенами
Непосредственная внутриматочная доставка прогестагенов — широко применяемый удобный метод, обеспечивающий высокую комплаентность и позволяющий избежать эффекта первичного прохождения стероида через печень. Внутриматочная рилизинг-система (ЛНГ-ВМС) содержит 52 мг левоноргестрела (ЛНГ), который ежедневно высвобождается в дозе 20 мкг/сут в течение первых 5 лет ее использования. Максимальный сывороточный уровень ЛНГ, составляющий 150-200 пг/л, обычно достигаются в течение нескольких часов. Впервые ЛНГ-ВМС была одобрена FDA в 2000 г. в качестве метода контрацепции, а в 2007 г. эта внутриматочная система Национальным Центром женского и детского здоровья Великобритании была внесена в английские Клинические рекомендации. В 2009 г. FDA также одобрил эту рилизинг-систему для дополнительного лечения обильных менструальных кровотечений у пользователей ВМС. Известно, что ЛНГ-ВМС снижает кровопотерю и восстанавливает уровень гемоглобина при миоме матки с эффективностью до 74-97%, не оказывая воздействия на динамику миоматозных узлов. Снижение объема теряемой менструальной крови обусловлено антипролиферативным действием прогестагена на эндометрий, при этом модулирующие эффекты ЛНГ-ВМС не затрагивают функцию гипофиза и яичников. В исследованиях Q.Xy и соавт. (2010) установлено, что высокие концентрации ЛНГ подавляют пролиферацию клеток лейомиомы матки за счет активации процесса апоптоза. Г. Сайед и соавт. (2010) по результатам рандомизированного клинического исследования, сравнивая эффективность лечения кровотечений, связанных с миомой матки ЛНГ-ВМС и низкодозированными КОК, подтвердили больший эффект внутриматочного пути введения левоноргестрела (снижение обильности и продолжительности меноррагии до 1 дня, повышение уровня гемоглобина). A. Kriplani и соавт. (2011) опубликовали данные об уменьшении размеров миомы матки при использовании ЛНГ-ВМС, a R.B. Machado и соавт. (2013) приводят данные о снижении числа гистерэктомий у 89,5%женщин в перименопаузе при применении ЛНГ-ВМС.
В 2013 г. S. Islam и соавт. опубликовали большой обобщающий систематический обзор по терапевтическим эффектам внутриматочного введения левоноргестрела при миоме матки. Хотя этот препарат официально не зарегистрирован для лечения миомы матки, продолжительность его воздействия в течение месяца ограничена для внутриматочного введения (деформация полости матки, субмукозный узел миомы).
Таким образом, прогестагены не оказывают влияния на стабилизацию или уменьшение роста миоматозных узлов, но их используют на протяжении непродолжительного времени в качестве лекарственных средств для уменьшения объема аномальных маточных кровотечений и повышения уровня гемоглобина, а также для профилактики гиперпластических процессов эндометрия, сопряженных с миомой матки (уровень доказательности В).
Перорально назначаемые прогестагены уменьшают соответствующие симптомы. Эффективность лечения прогестагенами зависит от режима их назначения. При циклическом режиме (с 14-го по 26-й день цикла) эффективность составляет 0-20%, при 21-дневном режиме (с 5-го по 26-й день цикла) – 30-50%.
Однако согласно рекомендациям CNGOF 2008 г., эффективность лечения не зависит от схемы их приема, составляя 25-50% (уровень доказательности В).
Использование прогестагенов в составе низкодозированных КОК снижает симптоматику на 40-50% (уровень доказательности В). К сожалению, нет данных о преимуществах и эффективности непрерывного режима применения прогестагенов.
При наличии субмукозной миомы матки терапия прогестагенами нецелесообразна (уровень доказательности В).
Агонисты гонадотропин-рилизинг гормона аГнРГ – это синтетические пептиды, структурно похожие на нативный ГнРГ. Как и ГнРГ, аГнРГ способны взаимодействовать с рецепторами ГнРГ для достижения их биологического эффекта. аГнРГ обладают более мощным биологическим эффектом и более длительным периодом полувыведения по сравнению с нативным ГнРГ. аГнРГ стимулирует рецептор, и таким образом его пролонгированное воздействие ведет к эффекту даун-регуляции, что индуцирует гипоэстрогенное состояние, обусловленное подавлением гипофизарно-яичниковой функции, что и было использовано для лечения миомы матки. Лейпролида ацетат (аГнРГ) был одобрен FDA в 1999 г. как медикаментозное средство первой линии для лечения миомы матки. Такие же показания зарегистрированы в Европе и России у аГнРГ трипторелина и гозерелина.
аГнРГ являются эффективным средством для уменьшения размера миомы (около 50% от их первоначального объема). Несколько рандомизированных плацебо-контролируемых исследований свидетельствуют о том, что лейпролида ацетат значительно снижает не только объем матки и миоматозных узлов, но и выраженность симптомов, связанных с миомой, а также способствует улучшению самочувствия. Систематический обзор 26 рандомизированных контролируемых испытаний подтвердил, что использование аГнРГ в течение 3-4 мес. до хирургического лечения миомы матки уменьшает объем как матки, так и миоматозных узлов. Использование аГнРГ в предоперационном лечении при железодефицитной анемии эффективно снижает интраоперационную кровопотерю. Тем не менее, это лечение ограничено 3-6-месячным курсом, и когда лечение прекращали, через 2-3 мес. узлы миомы приобретали первоначальные размеры. Кроме того, лечение аГнРГ связано с побочными эффектами, включая гипоэстрогению, менопаузальные симптомы, такие как приливы и вагинит, а также снижение минеральной плотности кости. Установлено, что если для уменьшения размера миоматозного узла необходим продольный разрез, применение аГнРГ до операции позволяло избежать такого решения у большинства женщин. Пациенткам, которым планировали гистерэктомию, использование перед операцией аГнРГ позволяло ее выполнить влагалищным доступом.
Кроме того, предоперационное лечение аГнРГ сокращает продолжительность пребывания в стационаре. В сравнительном рандомизированном контролируемом исследовании, где выполняли абдоминальную миомэктомию с предоперационной аГнРГ-терапией (трипторелином) в течение 2 мес. и без нее, объем миомы в группе, получавшей трипторелин, уменьшился на 22%, тем не менее, во время операции объем кровопотери существенно не различался.
аГнРГ могут быть использованы в предоперационном лечении миомы матки, но только короткими курсами в связи с их побочными эффектами. аГнРГ снижают кровопотерю и до операции восстанавливают гемоглобин практически до нормальных значений. Терапия аГнРГ в течение 2-3 мес. перед оперативным вмешательством является достаточной. Add-back терапия (терапия поддержки) эстрогенами в адекватных дозах не оказывает значимого влияния на симптомы, связанные с миомой, и ее объем на фоне терапии аГнРГ.
аГнРГ являются эффективным средством предоперационного лечения пациенток с миомой матки и анемией (гемоглобин < 80 г/л) либо для уменьшения размеров миомы для облегчения выполнения оперативного вмешательства или при невозможности выполнения операции эндоскопически или трансвагинально (уровень доказательности А). Длительность предоперационного лечения ограничивается 3 мес. (уровень доказательности В).
Антагонисты ГнРГ
Антагонисты ГнРГ через 28 дней в эффективной дозе снижают объем матки, не влияя на объем миомы. Хотя через 28 дней лечения не отмечено влияния на уровень гемоглобина, но их применение ведет к уменьшению меноррагии/дисменореи. Препараты данной группы не являются лекарственными средствами для лечения миомы матки. Антагонисты ГнРГ не противопоказаны при использовании вспомогательных репродуктивных технологий при миоме матки (уровень доказательности С).
Ингибиторы ароматазы
В настоящее время ингибиторы ароматазы могут быть:
- стероидного типа (эксеместран);
- нестероидного типа (летрозол, анастразол)
Ингибиторы ароматазы не применяют для лечения миомы матки. Фармакологическое действие данных препаратов – противоопухолевое, ингибирующее синтез эстрогенов.
Механизм действия связан с ингибированием ароматазы в периферических тканях, в том числе жировой, что приводит к снижению синтеза эстрона, а затем эстрадиола из андрогенов (андростендион).
Показаниями к применению ингибиторов ароматазы являются: ранние стадии рака молочной железы, экспрессирующего рецепторы эстрогенов, у женщин в постменопаузе – в адъювантной терапии; ранние стадии рака молочной железы у женщин в постменопаузе после завершения стандартной адъювантной терапии тамоксифеном – в продленной адъювантной терапии; распространенные гормонозависимые формы рака молочной железы у женщин в постменопаузе – терапия первой линии; распространенные формы рака молочной железы у женщин в постменопаузе (естественной или вызванной искусственно), получавших предшествующую терапию антиэстрогенами.
В настоящее время единичные исследования оценивали эффективность ингибиторов ароматазы в лечении миомы матки.
В исследовании N. Duhan и соавт. (2013) были включены 30 пациенток в перименопаузе с множественной миомой матки (размеры узлов более 4 см), которые получали летрозол 2.5 мг в сутки в течение 12 нед. Установлено, что размеры миоматозных узлов уменьшились с 5.4±1.3 до 4.3±0.9 см (р<0.05) и объем миомы в целом уменьшился на 52.45% (р=0.00).В другом исследовании (Cochrane Database Syst Rev., 2013) 70 пациенток в постменопаузе получали ингибиторы ароматазы для лечения рака молочной железы. Действие летрозола на миому матки оценивали в разделе «побочные эффекты». Доказано, что объем миоматозных узлов через 12 нед. терапии сократился на 46 %.
Заключение: ингибиторы ароматазы быстро и эффективно уменьшают размеры миоматозных узлов, однако в связи с возможностью развития тяжелых побочных эффектов (приливы «жара», остеопороз, повышение АД, тромбоэмболии, артралгии и т.д.) данные препараты не показаны для лечения миомы матки и не являются официально зарегистрированным средством медикаментозного лечения миомы матки.
Модуляторы рецепторов прогестерона
Лейомиома матки, являясь прогестерон-зависимым патологическим процессом, развивается, как правило, при овуляторном менструальном цикле, а прогестерон – сильный индуктор ее роста. Опухолевые миоциты лейомиом отличаются от неизмененного миометрия более высокой экспрессией рецепторов как эстрогенов, так и прогестерона. Так, около 90% клеток лейомиомы экспрессируют рецепторы прогестерона (обе изоформы – RP-A и RP-B и их мРНК), который стимулирует в ее клетках выработку факторов роста и ингибитора апоптоза протоонкогена bcl-2. В результате в секреторную фазу цикла экспрессия маркеров пролиферации в клетках лейомиомы матки повышается, а активность апоптоза – снижается. Различные модуляторы рецепторов прогестерона подавляют рост лейомиомы матки и могут приводить к ее регрессии. Семейство модуляторов РП, представленное их различными лигандами, включает:
- агонисты прогестерона (прогестерон и прогестагены);
- антагонисты прогестерона (антипрогестины или антигестагены – мифепристон);
- вещества со смешанным действием агонистов и антагонистов прогестерона (селективные модуляторы РП – СМРП: улипристал, азоприснил).
В некоторых классификациях все 3 группы веществ объединены в одно семейство СМРП. С этим трудно согласиться, так как принципиально важно различать СМРП и антагонисты прогестерона. Антигестагены даже в очень низких дозах способны прерывать беременность. СМРП не прерывают беременности вследствие их тканеспецифического смешанного эффекта как антагонистов и агонистов прогестерона.
Антагонисты прогестерона (мифепристон) блокируют рецепторы прогестерона и глюкокортикостероидов, вследствие чего снижают тяжесть менометроррагии, уменьшают объем матки и незначительно сокращают размеры миоматозных узлов. В связи с усилением сократительной способности миометрия, повышением его чувствительности к простагландинам, стимуляции выработки ИЛ-8 в хориальной и децидуальной тканях мифепристон применяют для прерывания маточной беременности ранних сроков [Кондриков Н.И., 2008; Chabbert-Buffet N., et al., 2005]. Он обладает антипролиферативным и проапоптотическим эффектом в отношении лейомиом, причем после прекращения лечения возобновление роста миоматозных узлов выражено слабее, чем после терапии аГнРГ. В эндометрии в зависимости от дозы и длительности приема мифепристон оказывает главным образом пролиферативный эффект, вызывая обратимое утолщение эндометрия с развитием его изменений, сходных с простой гиперплазией. Для миомы матки зарегистрирована доза мифепристона 50,0 мг. Однако данная доза, которую, согласно инструкции по применению препарата надо принимать ежедневно, длительно, часто приводит к гиперплазии эндометрия и вызывает менометроррагию. Кроме того, уменьшение размеров узлов миомы матки незначительно, что вместе с гиперпластическим процессом и кровотечениями в настоящее время ограничивает использование данного препарата. Несмотря на довольно продолжительный срок применения мифепристона на рынке, широкого распространения для консервативного лечения миомы матки он не получил.
В настоящее время эффекты перечисленных выше препаратов для лечения миомы матки, дозировка, схемы их применения подробно описаны как в зарубежной, так и отечественной литературе.
Селективные модуляторы рецепторов прогестерона. Улипристал является новым, разрешенным к применению при лечении миомы матки, в том числе и на нашем рынке. В связи с этим мы считаем необходимым привести соответствующие данные литературы. СМРП – это новая и перспективная группа лекарственных препаратов, преимущественно стероидов, предназначенных для таргетной терапии патологических процессов, развивающихся в прогестерончувствительных тканях [Attardi B.J. et al., 2004; Chabbert-Buffet N. et al., 2005; Chwalisz K. et al., 2005; Brenner A.M. et al., 2010; Donnez J. et al., 2012]. Препарат улипристал (зарегистрированный в 2012 г. в Европе и России) – это пероральный синтетический СМРП, характеризующийся тканеспецифическим смешанным эффектом антагониста и агониста прогестерона [Chabbert-Buffet N. et al., 2005; Chwalisz К. et al. 2005; Brenner A.M. et al. 2010; Donnez J. et al., 2012].
In vivo улипристал в течение 12 нед. у женщин с миомой матки приводил к апоптозу, достоверно более значимому, чем при использовании аГнРГ [Horak et al., 2012]. Клинические эффекты улипристала оценивали в двух исследованиях, причем при наличии не менее одного миоматозного узла > 3 см, < 10 см и размерах матки < 16 нед. беременности, при всевозможных локализациях миомы матки. Рандомизированное с параллельными группами двойное слепое плацебо-контролируемое исследование III фазы PEARL I [Donnez J et al., 2012] отслеживало эффекты двух (5 и 10 мг) доз улипристала.
Согласно результатам исследования, маточное кровотечение прекращалось у 91 и 92% женщин, принимавших по 5 и 10 мг улипристала соответственно по сравнению с 19% женщин, принимавших плацебо (Р<0,001). Аменорея наступила у 73, 82 и 6% пациенток соответственно, причем у большинства женщин, принимавших улипристала, аменорея наступала в течение 10 дней. Среднее изменение общего объема миомы составило -21, -12 и +3% (Р<0,01 в обеих группах по сравнению с плацебо). По сравнению с плацебо обе дозировки улипристала ацетата уменьшали боль при оценке с помощью Краткого опросника боли Мак-Гилла.
Улипристал индуцировал доброкачественные гистологические изменения эндометрия, которые исчезали через 6 мес. после окончания терапии. Значимых изменений в частоте развития нежелательных явлений в 3 группах терапии не выявлено. Наиболее распространенными побочными реакциями при приеме улипристал были головная боль и болезненность молочных желез. В двойном слепом исследовании, контролируемом с помощью 2 плацебо, III фазы PEARL II [Donnez J. et al., 2012] сравнивали улипристал с аГнРГ (лейпролида ацетатом). Маточное кровотечение прекращалось с сопоставимой частотой у пациенток, принимавших улипристал и лейпролида ацетат, но прекращение обильного кровотечения статистически чаще наблюдали при приеме улипристала. Среднее время до наступления аменореи составляло 7 и 5 дней у пациенток, принимавших по 5 и 10 мг улипристала соответственно, и 21 день — у принимавших лейпролида ацетат. При всех видах терапии уменьшался объем трех самых больших миом на 36, 42 и 53% соответственно, но эффект улипристала, отслеженный в течение 6 мес. последующего наблюдения у пациенток, не подвергавшихся гистерэктомии или миомэктомии, оказался более устойчивым. Приливы жара наблюдали у 11 и 10% пациенток, принимавших по 5 и 10 мг улипристала соответственно, и у 40% принимавших лейпролида ацетат (р<0,001). Значимых отличий в отношении других нежелательных явлений не было.
Таким образом, таблетки улипристала 5 мг являются первым в своем классе препаратом СМРП для перорального применения. Прием этого препарата 1 раз в день в течение 12 нед. (по сравнению с инъекциями аГнРГ) способствует остановке маточного кровотечения, коррекции анемии и уменьшению объема миомы. Улипристала ацетат улучшает качество жизни и не оказывает гипоэстрогенных побочных эффектов, в отличие от аГнРГ. Сегодня он рекомендован для предоперационной терапии умеренных и тяжелых симптомов лейомиомы матки (прежде всего маточных кровотечений) у женщин репродуктивного возраста старше 18 лет (перорально 5 мг 1 раз в сутки в течение 3 мес). У больных с лейомиомами матки доказана эффективность улипристала в плане уменьшения размеров миоматозных узлов и в контроле маточных кровотечений. Лечение улипристалом приводит к уменьшению менометроррагий и нередко к аменорее уже в течение первых 7-10 дней терапии. Возобновление нормального менструального цикла происходит, как правило, в течение 4 нед. после завершения курса лечения. Прекращение маточных кровотечений отмечено более чем у 90% больных с лейомиомой матки, при этом аменорея (до 82% больных) развивалась быстрее, чем при лечении аГнРГ (соответственно на 7-е и 21-е сутки). Это способствовало скорейшему восстановлению показателей уровней гемоглобина и железа в крови, что особенно важно в предоперационной подготовке этого контингента больных. Полагают, что при лечении улипристалом прекращение менометроррагий и развитие аменореи связаны со специфическими и обратимыми изменениями эндометрия (названным РАЕС), хотя патогенез аменореи остается дискутабельным [Donnez J. et al., 2012] (см. соответствующую главу Рекомендаций). Кроме того, улипристал даже после 3-месячного курса терапии оказывал более пролонгированный эффект в плане уменьшения размеров лейомиомы матки по сравнению с быстрым возобновлением роста миоматозных узлов после окончания применения антигестагенов [Donnez J. et al., 2012]. Улипристал уменьшает также болевой синдром, способствует повышению качества жизни и вызывает существенно меньшее количество побочных реакций (приливы, остеопороз, депрессия и др.), по сравнению с аГнРГ, что обусловлено, как полагают, главным образом сохранением продукции эстрогенов на уровне средней стадии фолликулярной фазы менструального цикла [Chabbert-Buffet N. et al., 2005; Chwalisz К. et al., 2005; Brenner A.M. et al., 2010; Donnez J. et al., 2012].
7.1. МИОМА МАТКИ И БЕСПЛОДИЕ
Имеются убедительные данные о негативном влиянии миомы матки с субмукозным расположением узла на исходы экстракорпорального оплодотворения (ЭКО). Так, частота наступления беременности у этих больных снижена почти в 4 раза по сравнению с пациентками, у которых нет миомы, частота имплантации снижена соответственно в 2 раза, а частота самопроизвольных абортов чаще бывает при субмукозной миоме более чем в 4 раза.
Однако при интрамуральной локализации миомы получены противоречивые данные о снижении частоты не только имплантации, но и наступления беременности после ЭКО. Доказано снижение частоты наступления беременности (на 40%), родов (на 49%) в 3 попытках ЭКО/ИКСИ у больных с интрамуральной формой миомы матки (322 больных) по сравнению с больными, у которых нет миомы матки (112 больных). Существует и противоположное мнение, согласно которому частота беременности и родов после ЭКО у больных с интрамуральной и субсерозной формой миомы матки (средний диаметр узлов в исследовании составил не более 5 см) не отличается от частоты беременности у пациенток, у которых нет миомы матки.
Интрамуральные миомы больших размеров (более 4-5 см) негативно влияют на частоту наступления беременности и должны быть удалены перед ЭКО. Однако если удаление миомы более 5 см перед ЭКО признано, то у женщин, ожидающих наступление спонтанной беременности, систематически удалять такие миомы не следует, так как существует риск формирования спаек после миомэктомии и, как следствие, развитие трубно-перитонеального бесплодия.
ЭКО после миомэктомии:
Влияние предшествующей миомэктомии на результативность ЭКО спорно. Если даже миома матки напрямую не влияет на беременность (по данным многих исследователей), но само по себе наличие миомы может негативно воздействовать на вынашивание и роды в связи с разнообразием вызываемых осложнений.
Безусловно, если у пациентки проведена миомэктомия субмукозного узла перед ЭКО, это благоприятно сказывается на имплантацию эмбриона, течение беременности и родов.
Если же у пациентки, планирующей ЭКО, диагностирована миома интерстициальной или субсерозной локализации, то, с одной стороны, удаление миомы будет способствовать неизбежному формированию рубца в миометрии, что может привести к самопроизвольному выкидышу. С другой стороны, отсутствие опухолевидных образований в матке при беременности снижает риск осложнений беременности и родов. Таким образом, показания к миомэктомии интрамуральных и субсерозных узлов у пациенток, планирующих ЭКО, должны быть расширены.
Беременность после миомэктомии. Частота наступления самопроизвольной беременности у пациенток, перенесших миомэктомию, варьирует от 45 до 61%. Данные показатели зависят от размеров, количества и локализации узлов, а также от выбранного доступа оперативного вмешательства.
Нет убедительных доказательств в пользу того, что миомэктомия увеличивает риск прерывания беременности. Наоборот, некоторые исследователи указывают на тот факт, что частота самопроизвольных выкидышей после миомэктомии снижается с 41 до 19%.
Течение беременности и родов после миомэктомии сравнимо с течением беременности и родов у пациенток, не имеющих заболевания матки.
7.2. МИОМА МАТКИ И БЕРЕМЕННОСТЬ
Диагноз миомы во время беременности не прост и однозначен. Только 42% крупных узлов миомы (>5 см) и 12,5% более мелких миоматозных узлов (3-5 см) можно диагностировать при функциональном осмотре. Диагностическая значимость УЗИ для обнаружения мелких миоматозных узлов во время беременности ограничена (1,4- 2,7%), в первую очередь в связи с трудностью дифференциации миомы от физиологического утолщения миометрия.
Осложнение беременности
Большинство миом матки протекает бессимптомно.
В I триместре возможно развитие следующих осложнений: рост миомы; угрожающий выкидыш; неразвивающаяся беременность; кровотечение; гипоплазия хориона.
Во II триместре: быстрый рост и нарушение питания миомы; низкая плацентация; истмико-цервикальная недостаточность; плацентарная недостаточность; ПОНРП; развитие преэклампсии.
В III триместре: неправильное предлежание и положение плода; угрожающие преждевременные роды; плацентарная недостаточность; гипоксия и гипотрофия плода; преэклампсия.
Развитие осложнений зависит от размеров миоматозных узлов, их количества, локализации относительно слоев матки, эхогенности структуры, а гестационные осложнения – от особенности локализации узлов миомы относительно не только плаценты, но и нижнего маточного сегмента.
Боль является наиболее частым осложнением миомы во время беременности и чаще всего бывает у женщин во II и III триместрах при размере миомы более 5 см. Сильная локализованная боль в животе возможна при «красной дегенерации», сдавлении миомы или перекруте ножки субсерозной миомы. В исследовании ИЗ беременных женщин, в 9% наблюдений на УЗИ были установлены гетерогенные и кистозные изменения, указывающие на развитие «красной дегенерации». Из этих 10 женщин у 7 была сильная боль в животе. Предложено 3 основные теории для объяснения сильной боли, связанной с «красной дегенерацией».
При быстром росте миомы рост ткани миоматозного узла перерастает ее кровоснабжение, что приводит к аноксии ткани и некрозу. Рост матки по мере развития беременности приводит к изменению ее архитектуры, формированию перегибов сосудов, что может вызвать ишемию и некроз даже при отсутствии роста миомы матки. Боль может возникать вследствие выхода простагландинов из клеточных повреждений в стенке матки. Роль простагландинов в развитии боли подтверждает наблюдение, что ибупрофен и другие ингибиторы простагландин-синтетазы эффективны и быстро снимают боль.
Ранние сроки беременности
Самопроизвольное прерывание беременности чаще наблюдают у беременных с миомой по сравнению с контрольной группой без миомы матки (14 и 7,6% соответственно). В исследованиях установлено, что размер миомы не влияет на частоту самопроизвольного прерывания беременности, но множественные миомы матки увеличивают процент выкидышей по сравнению с наличием одного узла (23,6 и 8,0% соответственно).
Расположение миоматозных узлов имеет большое значение, так как выкидыши чаще бывают у женщин с миомой матки, расположенной в теле матки, реже прерывание беременности диагностируют при расположении миомы в области нижнего сегмента матки.
Механизм, с помощью которого миома матки вызывает самопроизвольный выкидыш, не ясен.
Кровотечение на ранних сроках беременности
От расположения миомы матки зависит риск развития кровотечения, которое на ранних сроках беременности бывает значительно чаще, если плацента формируется под узлом или близко к нему, по сравнению с беременностью, в которой нет контакта между плацентой и миоматозным узлом (60 и 9% соответственно).
Преждевременные роды и преждевременный разрыв плодных оболочек
Риск развития преждевременных родов и преждевременного излития вод значительно выше у беременных женщин с миомой матки, чем у женщин без миомы матки (16,1 и 8,7; 16 и 10,8% соответственно). Расположение плаценты на миоматозном узле представляется независимым фактором риска преждевременных родов, и не является фактором риска преждевременного излития вод.
Отслойка плаценты
Сообщения противоречивы, риск отслойки плаценты увеличивается в 3 раза у женщин с миомой матки. Подслизистые миомы, ретроплацентарные миомы и миомы объемом > 200 см3 рассматривают независимыми факторами риска отслойки плаценты. Одним из возможных механизмов отслойки плаценты может быть снижение притока крови к миоме и прилегающим тканям, что вызывает частичную ишемию и децидуальный некроз в плацентарных тканях, прилегающих к миоме.
Предлежание плаценты
Отношения между миомой матки и предлежанием плаценты были рассмотрены только в 2 исследованиях, в которых отмечено, что миома матки в 2 раза увеличивает риск предлежания плаценты.
Задержка роста плода и аномалии плода
Задержка роста плода не зафиксирована в исследованиях, так как они не учитывали возраст матери и гестационный возраст при миоме матки у беременных. Высказано предположение, что миома матки оказывает повышенный риск на формирование маловесного плода.
Редко миомы матки больших размеров могут деформировать внутриматочную полость и сжимать части плода, способствовать формированию деформаций и уродств. Ряд аномалий развития плода был зарегистрирован у женщин с большими подслизистыми миомами: долихоцефалия (боковое сжатие черепа плода), кривошея (аномальное скручивание шеи), укорочение конечностей плода.
Роды и родоразрешение
В процессе родов миома может вызывать слабость родовой деятельности, неправильное предлежание плода или создавать препятствие для прохождения плода по родовым путям. Обычно по мере развития беременности миома выходит за пределы таза и может осложнять роды через естественные родовые пути. Большая шеечная или истмическая миома чаще бывает неподвижной, поэтому необходимо кесарево сечение.
Большие размеры матки, множественная миома матки и миомы нижнего маточного сегмента рассматривают как независимые факторы риска развития аномалий родовой деятельности.
Несмотря на увеличение риска кесарева сечения, наличие миомы матки, даже большой миомы (>5 см), не следует рассматривать как противопоказание к родам. Способ родоразрешения заранее обсуждается с пациенткой и составляется информированное согласие.
Послеродовое кровотечение
Исследования о связи между миомой и послеродовым кровотечением противоречивы. Послеродовое кровотечение наблюдают чаще у женщин с миомой матки (2,5 и 1,4% соответственно). Миома может исказить архитектуру матки и нарушить сократительную способность миометрия, что может привести к атонии матки и послеродовому кровотечению.
Задержка плаценты
Задержка плаценты чаще бывает у женщин с миомой, расположенной в нижнем маточном сегменте. Кумулятивные данные свидетельствуют о том, что задержка плаценты чаще наблюдают у всех женщин с миомой матки по сравнению с контрольной группой независимо от расположения миомы (1,4 и 0,6% соответственно).
Разрыв матки после миомэктомии
Имеются многочисленные сообщения, описывающие разрывы матки в родах после лапароскопических миомэктомий. Исследования подтверждают, что разрывы матки происходят до начала родовой деятельности на месте предварительной лапароскопической миомэктомии, абсолютный риск разрыва матки после лапароскопической миомэктомии составляет 0,5-1,0%. Однако в имеющихся данных отсутствуют указания о характере вмешательства, локализации узлов, технике зашивания, хирургических энергиях и прочих нюансах (течение послеоперационного периода, реабилитации, сроки наступления беременности и т.д.). В любом случае беременную после миомэктомии любым доступом следует рассматривать как с повышенным риском осложнений и высоким процентом готовности к оперативному родоразрешению в плановом порядке, а возможно и к досрочному родоразрешению.
Ведение во время беременности
Во II триместре беременности миома матки может быстро увеличиваться, вследствие чего нарушается кровоснабжение опухоли, и развиваются дегенеративные изменения, которые проявляются болью и локальным напряжением мышц живота.
Во время боли лечение, как правило, консервативное: постельный режим, гидратация, анальгетики. Ингибиторы простагландин-синтетазы (НПВС) следует использовать с осторожностью, особенно в III триместре. При сильной боли необходимы дополнительное назначение обезболивающих препаратов, эпидуральная анестезия или хирургическое лечение (миомэктомия).
Во время беременности при миоме матки целесообразно проводить регулярно УЗИ для оценки состояния не только плода, но и миомы матки, каждые 4 нед до срока родов.
При локализации миомы в задней стенке матки беременность чаще осложняется выкидышами, кровотечениями на ранних сроках беременности. Расположенные узлы в задней стенке матки связаны с более выраженной тазовой болью.
Миомэктомия во время беременности
Миомэктомия может быть относительно безопасна для плода и матери в I и II триместрах беременности.
Показания к миомэктомии во время беременности: большие размеры опухоли; перекрут ножки узла миомы; ущемление опухоли в малом тазу; быстрый рост опухоли, вызывающий дискомфорт; некроз миоматозного узла, боль в животе, отсутствие эффекта от консервативного лечения; расстояние между миомой и полостью матки более 5 мм, во избежание вскрытия полости матки во время оперативного вмешательства;
Обязательным является подписание формы согласия на оперативное вмешательство после информирования о рисках миомэктомии.
Требования при проведении миомэктомии: срок беременности между 15-й и 19-й неделями беременности; нижнесрединная лапаротомия или срединный разрез над пупком; вертикальный надрез над миомой, выделение миомы тупым и острым путем; после удаления миомы тщательный гемостаз, миометрий закрывать двумя слоями узловых швов викриловой нитью номер 2/0; по показаниям дренирование брюшной полости; контроль УЗИ сразу после операции для оценки жизнеспособности плода; обезболивание – эпидуральная анестезия или эндотрахельный наркоз.
Ведение послеоперационного периода: профилактика гнойно-септических осложнений; токолитическая терапия в течение 4 дней послеоперационного периода; контроль УЗИ на 4-е сутки послеоперационного периода, в дальнейшем через 2 нед; выписка на 7-й день послеоперационного периода.
Во всех исследованиях после консервативной миомэктомии во время беременности родоразрешение проводят путем кесарева сечения. Контроль гемостаза и при необходимости профилактика осложнений.
Кесарево сечение и миомэктомия
Показания к кесареву сечению при миоме матки: большие миомы, размеры и локализация которых препятствуют родоразрешению через естественные родовые пути; «красная дегенерация» узлов миомы, установленная до родов; перекрут субсерозного миоматозного узла; миома матки, сопровождающаяся выраженным нарушением функции смежных органов; миома матки у пациенток, перенесших ранее миомэктомию; акушерские показания.
Показания к миомэктомии во время кесарева сечения: субсерозные узлы на тонком основании; субсерозные узлы на широком основании, исключая расположенные на сосудистых пучках и в нижнем сегменте матки; узлы миомы матки в области разреза на матке при кесаревом сечении.
7.3. МИОМА МАТКИ В ПЕРИИ ПОСТМЕНОПАУЗЕ
Миома матки в перименопаузе
В перименопаузе основную роль в патогенезе роста миомы матки играют снижение апоптоза и наличие новых очагов пролиферации.
Клинические проявления при миоме матки связаны с возрастными функциональными изменениями репродуктивной системы женщины.
Следует отметить, что у больных перименопаузального возраста миомэктомия целесообразна только при нереализованной репродуктивной функции женщины и категорическом отказе пациентки от гистерэктомии.
В пременопаузальном возрастном периоде основными показаниями к хирургическому лечению миомы матки являются нарушения менструального цикла, сопровождающиеся анемизацией, миома в сочетании с аденомиозом, субмукозная локализация узла. Миома матки, требующая хирургического лечения, у больных этого возраста характеризуется наиболее длительным и клинически выраженным течением (нарушение менструального цикла в виде обильных, болезненных менструаций продолжительный период времени), а также значительной анемизацией. По количеству показаний к хирургическому лечению миома в пременопаузе наиболее «симптомная», так как у большинства больных выявляют 3 и более показаний к оперативному вмешательству. Как правило, для больных этой возрастной группы характерно большое количество внутриматочных вмешательств (искусственные аборты, раздельные диагностические выскабливания полости матки и цервикального канала) и операций на матке (кесарево сечение, миомэктомии и др.).
Кроме того, пациентки пременопаузального возраста часто имеют такие сопутствующие заболевания как аденомиоз, гиперпластические процессы эндометрия, инфекционно-воспалительные болезни женских половых органов. Морфометрический анализ операционного материала подтвердил, что у пациенток в возрасте пременопаузы миома матки, требующая хирургического лечения, представлена множественными узлами, расположенными по передней, задней стенкам, в дне матки, а у каждой пятой пациентки – с субмукозной локализацией одного из узлов. У пациенток пременопаузального возраста выявлены наибольшая интенсивность пролиферации гладкомышечных клеток миоматозных узлов, а также значительное замедление апоптоза при наличии сравнимых показателей в других возрастных периодах.
У пациенток перименопаузального возраста медикаментозную терапию миомы матки можно рассматривать как предпочтительный вариант терапии при отсутствии строгих показаний к хирургическому лечению заболевания. Наиболее эффективными гормональными препаратами для лечения миомы матки являются аГнРГ.
На протяжении довольно длительного времени использовали различные прогестагены. В настоящее время применение гестагенов оправдано только при сочетании миомы матки (небольшие размеры) с гиперпластическими процессами эндометрия и аденомиозом у женщин пременопаузального периода при постоянном динамическом наблюдении.
Сегодня также используют антипрогестин – мифепристон. Благодаря своим тканеселективным свойствам (избирательное действие на РП в тканях-мишенях), мифепристон применяют в качестве адъювантной терапии больных с миомой матки.
В последние годы появились работы, указывающие на определенную эффективность применения СМРП для консервативной терапии миомы матки. Наиболее эффективными из этой группы препаратов являются азоприснил и улипристал.
В качестве монотерапии миомы матки у женщин перименопаузального возраста из числа препаратов с преимущественно антигонадотропными свойствами также можно применять даназол и гестринон.
Существуют исследования, достоверно доказывающие уменьшение размеров миомы матки после применения ингибитора ароматазы летрозола у женщин в пременопаузе, а также работы, направленные на сравнение эффективности применения аГнРГ и ингибитора ароматазы, летрозола, показывающие большую эффективность последнего у больных с миомой матки. Также описано успешное лечение симптомной миомы матки в перименопаузе с применением нестероидного ингибитора ароматазы фадрозола.
Антагонисты ГнРГ. Одним из главных ограничений для широкого использования антагонистов ГнРГ в лечении лейомиомы является короткий период полураспада этих препаратов и отсутствие депо-форм. Одним из исследуемых и перспективных препаратов этой группы является элаголикс, терапевтические дозы которого до сих пор не определены.
Селективные модуляторы рецепторов эстрогенов: а именно, ралоксифен мало влияет на биосинтез коллагена в клетках здорового миометрия, однако значительно ингибирует биосинтез коллагена в клетках лейомиомы. Тем не менее, в одной из работ сообщалось, что размер миомы у женщин в пременопаузе оставался без изменений на фоне применения ралоксифена в течение 2 лет.
Аналоги соматостатина. Выявлено, что при высоком уровне гормона роста у больных с акромегалией распространенность миомы матки по сравнению с этим заболеванием среди населения в целом более высокая. Ланреотид – аналог соматостатина-индуцировал уменьшение объема матки на 42 % в результате его 3-месячного применения. Эти данные свидетельствуют о том, что аналоги соматостатина могут быть потенциально новым направлением в терапии миомы матки. В настоящее время недостаточно данных о безопасности долгосрочного использования препаратов данной группы.
Существуют исследования о применения витамина D в терапии миомы матки.
Миома матки в постменопаузе
Для миомы матки в постменопаузе характерны некоторые особенности морфологического строения, свидетельствующие об их меньшей пролиферативной активности по сравнению с миомой матки у женщин более молодого возраста. Это выражается в гипотрофии мышечных клеток, разрастании соединительной ткани и возрастании количества дистрофических изменений. В постменопаузе узлы миомы, возникшие еще в пременопаузе, так же, как и матка, подвергаются инволюции – уменьшается их диаметр, причем узлы, имевшие повышенную эхоплотность (фибромиома), претерпевают наименьшие изменения, а узлы средней или повышенной эхогенности (лейомиома) уменьшаются наиболее заметно. Наряду с этим повышается эхоплотность, особенно капсулы миоматозных узлов, что может приводить к ослаблению эхосигнала и затруднять визуализацию внутренней структуры миоматозных узлов. Редко встречается кистозная дегенерация узла миомы (субсерозная локализация) с множеством полостей и гипоэхогенным содержимым. При исследовании кровотока в миоматозных узлах после атрофии, интранодулярная регистрация цветовых эхосигналов нехарактерна, перинодулярный кровоток скудный. При интерстициальных узлах атрофические процессы в матке в постменопаузе могут приводить к усилению центрипетальных тенденций и появлению субмукозного компонента миоматозного узла. Субмукозное расположение миоматозных узлов в постменопаузе может способствовать появлению кровотечения.
В период постменопаузы показатели уровня экспрессии рецепторов к половым стероидным гормонам в клетках миомы достоверно ниже, чем в других возрастных группах, что связывают с развитием инволютивных процессов в половой системе женщин. Регресс миомы матки в постменопаузе обусловлен повышением уровня апоптоза при снижении пролиферативной активности, что проявляется достоверным снижением значений белка Вс 1-2 в тканях по отношению к данным больных с нерегрессирующей миомой матки и здоровых женщин в постменопаузе.
Определение экспрессии ароматазы в клетках миомы является важным с точки зрения выявления патогенеза опухолей и потенциальных направлений терапии. Заметно возрастает число исследований, которые предполагают, что у женщин в постменопаузе эстрогены, локализованные в опухолевых клетках, происходят из ароматизации in situ в патологически нарушенной ткани и что они действуют локально как митогенный фактор, способствующий росту опухоли независимо от концентрации эстрогенов в сыворотке крови.
У женщин в постменопаузе циркулирующие эстрогены происходят главным образом из периферической конверсии андрогенов. Такая конверсия имеет место в основном в периферических тканях, но, как подтверждено результатами исследований экспрессии гена ароматазы, локальный синтез андрогенов в карциноме эндометрия проявляется также, если количество продуцируемых гормонов недостаточно для увеличения пула эстрогенов в периферической крови. В эксперименте доказано, что клетки миомы способны синтезировать достаточное количество эстрогенов для поддержания собственного роста.
Увеличение матки и/или миоматозных узлов в постменопаузе, если оно не стимулировано МГТ, всегда требует исключения гормонпродуцирующей опухоли яичников или саркомы матки. Рост миомы в постменопаузе является показанием к хирургическому лечению – гистерэктомии.
Макроскопические характеристики миомы матки, лечение которой хирургическое, в возрасте постменопаузы различаются преимущественно единичными, но небольшими по морфометрическим параметрам опухолевыми узлами. В постменопаузальном периоде миома матки, требующая хирургического лечения, сочетается у каждой третьей пациентки с хроническим эндометритом, гиперпластическими процессами эндометрия, аденомиозом. Таким образом, у пациенток постменопаузального возрастного периода имеет место сочетание нескольких триггерных факторов, дополняющих друг друга, которые приводят к необходимости оперативного вмешательства при миоме матки: метаболические нарушения (ожирение), хронические заболевания печени, гиперплазия тека-ткани и кистомы яичников в сочетании с хроническим воспалением матки и придатков, аденомиозом и гиперпластическими процессами эндометрия.
Эхографически при субмукозной форме миомы матки диагноз основывается на визуализации округлого или овоидного образования среднего уровня звукопроводимости (близко к миометрию) в проекции полости матки. Однако в постменопаузе нередко невозможно определить соотношение интерстициального и субмукозного компонентов, поскольку М-эхо тонкое, сливается с капсулой узла и не позволяет четко определить границы полости матки. Диагностические трудности можно решить с помощью гидросонографии и гистероскопии. Гидросонография благодаря контрастированию полости матки дает возможность четко определить не только локализацию узла, соотношение интерстициального и субмукозного компонентов, но и состояние эндометрия.
При единичной субмукозной миоме матки небольших размеров в постменопаузе показана миомэктомия трансцервикальным доступом (гистерорезектоскопия) при наличии условий для проведения операции. Интерстициально-подслизистые узлы миомы в постменопаузе не являются показанием к хирургическому лечению при отсутствии патологических изменений эндометрия и яичников.
Существуют данные о применении в постменопаузе СМЭР – ралоксифена – синтетического нестероидного препарата. Исследования подтвердили, что ралоксифен значительно уменьшает размеры миомы у женщин в постменопаузе. Кроме того, у женщин, получающих аГнРГ, ралоксифен значительно уменьшает размеры лейомиомы и этот эффект поддерживается в течение 2 лет после окончания лечения [Palomba S. et al., 2005].
Влияние менопаузальной гормональной терапии (МГТ). Очевидно, что фибромиома после менопаузы должна регрессировать, но МГТ может остановить этот процесс и даже стимулировать рост узлов. При этом добавление прогестагенного компонента не уменьшает этот риск. Несколько различных клинических исследований свидетельствовали о росте фибромиомы на фоне трансдермального применения эстрогенного в сочетании с прогестагенным компонентом МГТ. Точно также инъекционные формы эстрогенов в сочетании с прогестагенами способствовали увеличению размеров и числа узлов миомы. Кроме того, в ряде работ было установлено, что назначение пероральной МГТ не вызывало значимого изменения размеров опухоли. В некоторых исследованиях по изучению влияния пероральной МГТ на миоматозные узлы не было представлено репрезентативной группы сравнения (женщины постменопаузального возраста, которые бы не получали МГТ). Однако в двух работах, которые включали такие группы сравнения, объем миомы незначительно уменьшился у женщин, не получавших МГТ в течение длительного времени. И только в двух исследованиях с включением контрольных групп высказано предположение, что назначение пероральной МГТ может замедлять нормальный менопаузальный регресс миомы матки.
Влияние МГТ на рост узлов миомы матки у женщин после менопаузы – сложная проблема, разрешимая только на основании дальнейших исследований. Яркой иллюстрацией этого является утверждение Polatti и соавт. (2000) о том, что увеличение объема или числа фибромиом матки во время приема МГТ в постменопаузе, вероятно, не связано исключительно с дозой и путем введения эстрогенного компонента, а возможно зависит от дозы и типа применяемого прогестагенового компонента. Для постменопаузы характерно снижение лигандопосредованного апоптоза, что установлено при исследовании соотношения циркулирующих Fas/FasL у женщин в постменопаузе, получающих МГТ. Половые стероидные гормоны оказывают влияние на рост лейомиомы, стимулируя клеточную пролиферацию в большей степени, чем механизмы апоптоза. Частота клеточной пролиферации ниже в постменопаузе, чем в репродуктивном возрасте, кроме того, она усиливается под действием прогестерона.
Однако миома матки – не противопоказание для МГТ. Препараты МГТ у больных миомой матки можно назначать, если у женщины имеется не более 2-3 узлов не более 3 см. Исключение – субмукозное расположение узла. При этом необходимо динамическое ультразвуковое исследование органов малого таза с доплеромерией 1 раз в 6 мес. При появлении интенсивного кровотока в узлах лечение должно быть отменено и врач решает вопрос о тактике дальнейшего ведения. На практике, большинство женщин с узлами небольших размеров или после оперативного лечения (гистерэктомия или надвлагалищная ампутация матки как с придатками, так и без) могут получать МГТ по показаниям, длительно без какого-либо увеличения миомы матки.
Как альтернатива, в ряде случает для лечения климактерического синдрома у женщин с миомой матки в постменопаузе возможно применение фитоэстрогенов (соевые изофлавоны), которые не приводят к увеличению размеров миоматозных узлов.
7.4. МИОМА МАТКИ И РАК
Лейомиома матки является эстрогенчувствительной опухолью и на ее возникновение оказывают влияние длительность эстрогенного воздействия (раннее менархе, избыточная масса тела). У женщин с ожирением повышено содержание эстрогенов благодаря их внегонадному синтезу ароматизацией в жировой ткани андрогенов в эстрогены, а также сниженному в печени синтезу основного транспортирующего стероиды белка – ГСПГ.
Злокачественные заболевания женских половых органов являются частой причиной смерти женщин во всем мире. Среди всех злокачественных опухолей гениталий рак яичника доминирует как причина смертности после рака эндометрия и шейки матки.
К факторам, связанным с повышенным риском развития рака яичника и эндометрия, относят гормональные нарушения, воспалительные заболевания, семейную предрасположенность, повреждения генома, повышенную экспрессию ростовых факторов, особенности питания, нарушения иммунной системы, вредные факторы окружающей среды, оксидативный стресс. Кроме того, в патогенезе рака этих локализаций могут участвовать и такие факторы, как ранее менархе, малое число родов, позднее наступление менопаузы, бесплодие.
Две трети всех узлов миомы подвергаются различной степени дегенерации: в 65% – это гиалиноз, в 15% – миксоматоз, а в 10% – кальциноз. Злокачественную дегенерацию или трансформацию лейомиомы в лейомиосаркому оценивают в пределах от 0,3 до 0,7%. В больших сериях исследований из 1429 гистерэктомий, выполненных по поводу миомы матки, лейомиосаркома была выявлена при гистологическом исследовании удаленной матки в 0,49% случаев. При наличии миомы матки вероятность лейомиосаркомы в 10 раз выше у женщины старше 60 лет, чем у женщины 40 лет.
Лейомиосаркома, которую относят к числу наиболее часто встречающихся сарком, может развиваться на фоне лейомиомы матки в 0,1-0,3% случаев. Патогенез лейомиосаркомы не изучен и не ясно, развивается эта опухоль из имеющейся лейомиомы или возникает как первичное новообразование. Принято считать, что лейомиома крайне редко трансформируется в лейомиосаркому и, как правило, возникает de novo. Эти данные подтверждает тот факт, что профили экспрессии микро-РНК в лейомиоме и лейомиосаркоме различаются.
Однако описаны подтвержденные гистологически, иммуногистохимически и цитогенетически случаи развития лейомиосаркомы в лейомиоме, когда в злокачественной опухоли обнаруживают элементы предшествующей доброкачественной. При цитогенетических исследованиях выявлены схожие изменения в хромосоме 10 как при клеточной миоме, так и при лейомиосаркоме.
Кроме того, потерю короткого плеча хромосомы 1 в клеточной миоме можно расценивать как этап злокачественной трансформации опухоли в лейомиосаркому. Почти все генетические аберрации в клетках миомы матки совпадают с таковыми в клетках лейомиосаркомы. Повышенная экспрессия плюрипотентного фактора роста акрогранина в гладкомышечных клетках может сопровождаться их злокачественной трансформацией. В литературе имеются единичные сообщения о выявлении лейомиосаркомы после ЭМА по поводу лейомиомы матки.
Клиническая симптоматика миомы и лейомиосаркомы матки практически не различается: периодическая тянущая боль внизу живота различной интенсивности, меноррагии. Степень выраженности симптомов зависит от количества опухолевых узлов, их размеров, локализации и темпов роста опухоли.
В настоящее время нет ни одного имиджевого метода неинвазивной диагностики, который бы позволял с высокой степенью достоверности дифференцировать лейомиосаркому от миомы матки. Только гистологическое исследование, зачастую с использованием иммуногистохимического метода, позволяет установить диагноз лейомиосаркомы. Отмеченный быстрый рост узла миомы повышает вероятность наличия злокачественной опухоли.
По мнению некоторых ученых, само наличие миомы матки связано с повышенным риском развития рака эндометрия. Особенно этот риск увеличивается при выявлении миомы матки после 30 лет и длительном существовании опухоли, а также у женщин с ожирением в перименопаузе. Однако при изучении гормонобусловленных факторов риска развития рака эндометрия не было выявлено связи этого заболевания с миомой матки. Ожирение при индексе массы тела, превышающем 25, особенно в молодом возрасте, расценивают как одно из ключевых составляющих развития рака эндометрия.
Таким образом, особое внимание за состоянием эндометрия у больных с миомой матки следует уделять в перименопаузальном периоде. Регулярное УЗИ органов малого таза с оценкой толщины и эхоструктуры эндометрия следует проводить не реже 1 раза в год. При подозрении на гиперпластический процесс эндометрия должна быть выполнена гистероскопия с прицельной биопсией эндометрия или в сочетании с раздельным диагностическим выскабливанием слизистой оболочки цервикального канала и полости матки.
Одновременно с миомой матки у женщины может быть доброкачественная, но обладающая инфильтративным ростом гладкомышечная опухоль, растущая за пределами матки. Это состояние классифицируют как лейомиоматоз, и необходима дифференциальная диагностика с метастазами лейомиосаркомы.
Внутривенный лейомиоматоз является редким заболеванием, когда доброкачественная гладкомышечная опухоль врастает в просвет сосуда и серповидно охватывает маточные и другие тазовые вены, нижнюю полую вену и даже полости сердца. Вопреки доброкачественному характеру опухоли она может приводить к смерти из-за сдавления просвета вен и полостей сердца. Внутривенный лейомиоматоз при поражении предсердий служит показанием к операции на сердце.
Доброкачественная метастазирующая лейомиома представляет собой миому матки, распространяющуюся гематогенным путем в легкие, органы желудочно- кишечного тракта, спинной и головной мозг. Обычно это состояние диагностируют у женщин после операции на тазовых органах.
Диссеминированный лейомиоматоз брюшины проявляется мелкими множественными узелками на поверхности как париетальной, так и висцеральной брюшины, в большом сальнике. Заболевание развивается у женщин репродуктивного возраста, в 70% случаев оно связано с приемом контрацептивов или беременностью, кроме того может сопровождаться образованием асцита.
Лечение этих диссеминированных доброкачественных лейомиом хирургическое, в объеме экстирпации матки с придатками, максимальном удалении опухолевых узлов за пределами матки, в сочетании с медикаментозной терапией аГнРГ, ингибиторами ароматазы или СМЭР.
Миома матки может быть одной из составляющих синдрома наследственного рака. Таким синдромом является наследственный лейомиоматоз в сочетании с раковой опухолью почки (синдром HLRCC), который наследуется по аутосомно-доминантному типу, проявляется развитием лейомиомы кожи, миомы матки и рано возникающего рака почки с крайне агрессивным течением.
Другой наследственный синдром, наследуемый также по аутосомно-доминантному типу и сцепленный с Х-хромосомой, – отоокулоренальный синдром Альпорта, проявляющийся гематурией, протеинурией, лейкоцитурией, тугоухостью, иногда катарактой, кроме того может сопровождаться диффузным лейомиоматозом с поражением матки.
Таким образом, у гинеколога, наблюдающего женщин с миомой матки, должна быть адекватная онкологическая настороженность для своевременного выявления случаев, подозрительных как на наличие лейомиосаркомы, так и рака эндометрия, особенно при наличии наследственного отягощения по злокачественным заболеваниям.
Приложение 1. Классификация доказательств и рекомендаций (Canadian Task Force on the Periodic Health Examination) Классификация убедительности доказательств
I. Доказательства получены как минимум в одном хорошего качества рандомизированном исследовании
II. Доказательства получены в нерандомизированном клиническом исследовании
II-1 Доказательства получены в контролируемом исследовании хорошего дизайна без рандомизации
II-2 Доказательства получены в аналитических исследованиях: когортном или случай-контроль с хорошим дизайном более, чем одном исследовательском центре
П-З Доказательства получены в разных по времени серий исследований с интервенцией или без. Существенные результаты в неконтролируемых экспериментах тоже могут рассматриваться как этот тип доказательств.
III. Мнение уважаемых авторитетов, основанное на клиническом опыте, описательных исследованиях, отчетах экспертных комитетов.
Градация достоверности рекомендаций в зависимости от уровня доказательств.
Уровень А—рекомендации основаны на хороших и последовательных научных доказательствах.
Уровень В— рекомендации основаны на ограниченных и противоречивых научных доказательствах.
Уровень С— рекомендации в основном базируются на консенсусе и мнении эксперта.
Приложение 2
Приложение 3
Приложение 4
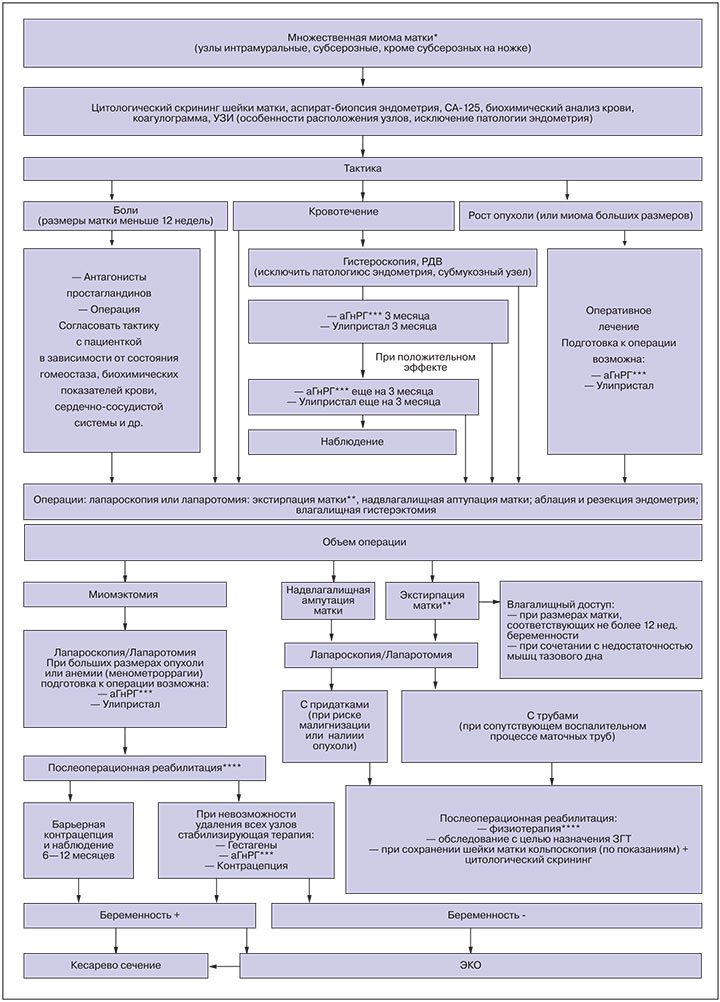
Приложение 5
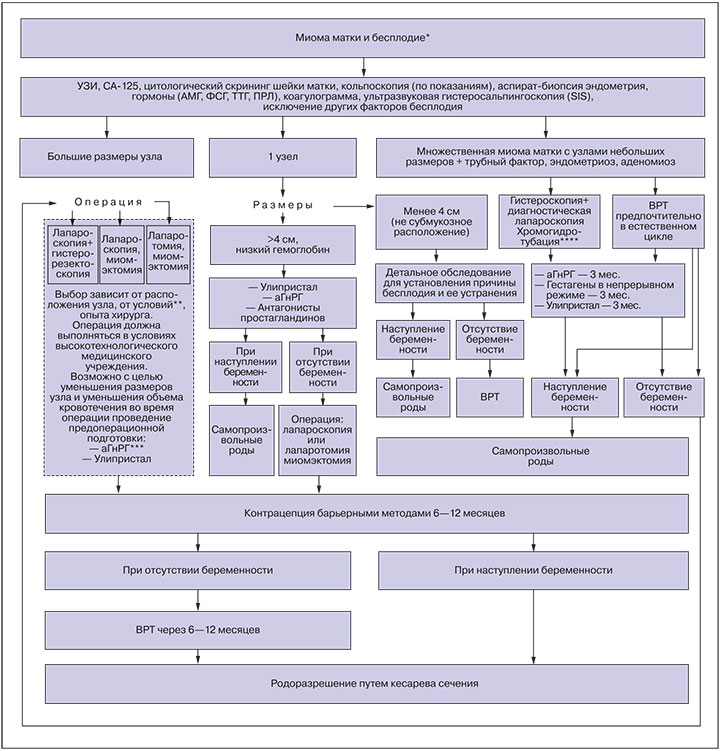
Список сокращений
аГнРГ – агонисты гонадотропин-рилизинг гормона
ВРТ – вспомогательные репродуктивные технологии
ГСПГ – глобулин, связывающий половые гормоны
ДДТ – дихлордифенилтрихлорэтан
ЕК – естественные киллеры
ИМТ – индекс массы тела
ИПФР – инсулиноподобный фактор роста
КОК – комбинированные оральные контрацептивы
ЛИФ (leukemia inhibitory factor, LIF) – лейкозингибирующий фактор
ЛМ – лейомиома матки
ЛНГ-ВМС – левоноргестрелсодержащая внутриматочная система
МГТ – менопаузальная гормональная терапия
МКБ 10 – Международная классификация болезней десятого пересмотра
ММК – межменструальные маточные кровотечения
МРТ – магнитно-резонансная томография
МСКТ – мультисрезовая спиральная компьютерная томография
НПВС – нестероидные противовоспалительные средства
ОМК – обильные менструальные кровотечения
ОР – относительный риск
ПОНРП – преждевременная отслойка нормально расположенной плаценты
ПЭС – постэмболизационный синдром
РП – рецепторы прогестерона
РЭ – рецепторы эстрогенов
α-РЭ – рецепторы эстрогенов α
β-РЭ – рецепторы эстрогенов β
СМРП (улипристал) – селективные модуляторы рецепторов прогестерона
СМЭР – селективные модуляторы эстрогеновых рецепторов
ТПФР – тумороподобный фактор роста
УЗАС – ультразвуковое триплексное ангиосканирование
УЗИ – ультразвуковое исследование
ЦДК – цветовое допплеровское картирование
ЭКО – экстракорпоральное оплодотворение
ЭМА – эмболизация маточных артерий
ЭФР – эндотелиальный фактор роста
bFGF – основной фактор роста фибробластов
G6PD – глюкозо-6-фосфатдегидрогеназа
MRgFUS – аблация ультразвуком под контролем магнитно-резонансной томографии
HMG – белки высокой мобильности
PIP – фосфорилированные фосфоинозитиды
PVA – поливиниловый спирт
RI – индекс резистентности
VEGF – сосудисто-эндотелиальный фактор роста Vmax – скорость кровотока



