Преждевременные роды (ПР) являются комплексной медико-социальной проблемой, связанной с решением задач по улучшению качества последующей жизни детей, родившихся недоношенными, и сопряженными материально-экономическими затратами. Тяжесть осложнений, связанных с недоношенностью, обратно пропорциональна гестационному сроку преждевременных родов. В этой связи в настоящее время наиболее актуальными становятся вопросы медикаментозной профилактики преждевременных родов. Очевидно, что ее эффективность зависит в первую очередь от корректного выбора контингента беременных. Согласно данным систематического обзора, достоверными факторами риска ПР являются ПР в анамнезе, при этом риск ПР в данной популяции составляет около 30% [1], и укорочение шейки матки до 25 мм в течение данной беременности – риск ПР в этом случае составляет около 25% [2, 3].
В последние годы появились убедительные данные о применении прогестерона в профилактике ПР у беременных с отсутствием клинических признаков угрозы прерывания беременности, но с ПР в анамнезе или с укорочением шейки матки, выявленным при трансвагинальном ультразвуковом исследовании (УЗИ) в 18–20 нед [4].
Первичная цель исследования: улучшение акушерских исходов путем снижения частоты ПР (роды до 34+0 недель) при профилактическом применении натурального микронизированного прогестерона (утрожестан) в дозе 200 мг в сутки вагинально в сроках 19–34 недели гестации у вышеуказанной категории женщин высокого риска по развитию ПР по сравнению с популяционной частотой ПР у данной категории беременных.
Вторичная цель исследования: улучшение неонатальных исходов и соответствующее снижение суммарного показателя неонатальной смертности и заболеваемости по сравнению с популяционными показателями.
Материал и методы исследования
Нами было проведено международное многоцентровое открытое клиническое исследование по изучению эффективности вагинального прогестерона в профилактике ПР (III фаза) с привлечением «асимптомных» женщин, беременных одним плодом, с ультразвуковыми признаками укорочения шейки матки (от 10 до 25 мм) на 18–236/7 неделе гестации (I группа) и/или имевших в анамнезе ПР (II группа).
В исследовании приняли участие 23 исследовательских центра из трех стран (Россия, Украина, Беларусь). Препарат был предоставлен фармацевтической компанией Besins Healthcare.
Критериями включения служили: возраст женщины не меньше 18 лет; наличие в анамнезе преждевременных родов или спонтанного прерывания беременности во втором триместре (≥ 16 недель и <37 37="">10 и <25 18="" 24="" 0="" p="">
Кроме того у всех женщин беременность должна быть подтверждена данными ультразвукового исследования в сроке ≤16 недель, чтобы удостовериться, что предполагаемая дата родов определена верно, наличие подписанного информационного листка пациента с формой информированного согласия
Критерии исключения были следующими: пациентки с наложенными швами на шейку матки к моменту включения в исследование; длина шейки матки менее 10 мм; клинические признаки угрожающих ПР; пороки развития матки, значимые врожденные пороки развития плода; маточное кровотечение; гиперчувствительность к прогестерону или противопоказания к его применению; непереносимость исследуемого препарата или одного из его компонентов, включая аллергические реакции на арахис и сою; подозрение на преждевременный разрыв плодных оболочек (ПРПО) или доказанный ПРПО при включении в исследование; многоплодная беременность; прием препаратов, для которых известно взаимодействие с прогестероном (например, бромокриптин, рифампицин, кетоконазол или циклоспорин); тяжелая соматическая патология.
Все пациентки были рекрутированы из общего потока беременных, наблюдавшихся в женских консультациях или в перинатальных центрах, центрах пренатальной диагностики и др.
В исследовании приняли участие 220 беременных, средний возраст которых составил 30±4,85 года. Использование IVRS (интерактивной голосовой системы) позволило включить в I группу 110 беременных с «короткой» шейкой матки, в II группу также 110 пациенток с ПР или преждевременным излитием околоплодных вод (до 37 нед беременности) в анамнезе.
В исследовании не было предусмотрено параллельной группы контроля. Отказ от плацебо или группы без лечения прогестероном был продиктован этическими соображениями. В качестве контроля использовались полученные из литературы популяционные риски преждевременных родов у пациенток с укорочением шейки матки и/или преждевременными родами в анамнезе [1–3].
Всем участницам ежедневно назначался вагинальный прогестерон (утрожестан) по 200 мг на ночь с момента рекрутирования в исследование до 336/7 недель или спонтанного прерывания беременности. Ни одна из участниц не выбыла из исследования по причине непереносимости препарата.
Первичной конечной точкой были ПР до 34 недель гестации.
Вторичными конечными точками были срок беременности к моменту родов, показатели неонатальной смертности и частоты отдельных компонентов первичного неонатального исхода: бронхолегочная дисплазия у детей, рожденных в сроке ≤32 недель беременности и повреждение головного мозга по данным нейросонографии; а также гибель плода и новорожденного после включения в исследование. Кроме того, учитывались такие неонатальные осложнения, как респираторный дистресс-синдром (введение сурфактанта, количество дней на респираторной поддержке (искусственная вентиляция легких – ИВЛ).
Количественные данные были суммированы с использованием средней, стандартного отклонения медианы, минимальных и максимальных величин. Качественные данные суммированы по частоте и проценту. Все статистические тесты являются двусторонними при уровне значимости 0,05.
Сравнение частотных показателей проводилось с помощью точного критерия Фишера или критерия χ2 (в зависимости от применимости критерия), непрерывных показателей – с использованием дисперсионной модели ANOVA (параметрической или непараметрической в зависимости от характера распределения данных), упорядоченных категориальных показателей – с использованием теста Манна–Уитни.
Первичная конечная точка оценивалась путем расчета абсолютного риска в сравнении с популяционным показателем, взятым из литературных данных. Представлены 95% доверительные интервалы для относительного риска и выявленного снижения относительного риска.
Результаты исследования
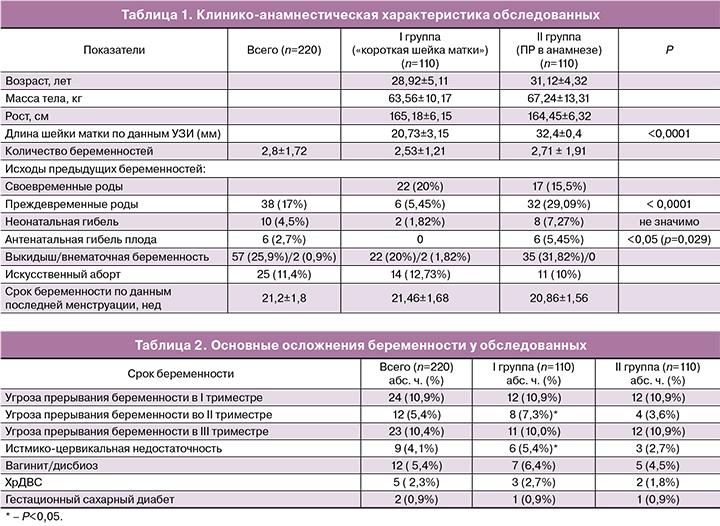
Возраст пациенток составил 20–42 года (медиана 30,0). Срок беременности при включении в исследование равнялся 21,15±1,6 нед, а среднее количество беременностей – 2,64±1,74. В I группе длина шейки матки колебалась от 13 до 25 мм (медиана 20,0) мм. Основная характеристика пациенток представлена в табл. 1.
Как видно из представленных в табл. 1 данных, статистически значимые различия в отношении частоты ПР в анамнезе и сопряженных с ними осложнений отмечались во II группе.
Анализ особенностей течения беременности (табл. 2) не выявил статистически значимых различий в частоте осложнений беременности, за исключением истмико-цервикальной недостаточности и связанной с ней угрозы прерывания беременности во II триместре среди пациенток I группы (p<0,05).
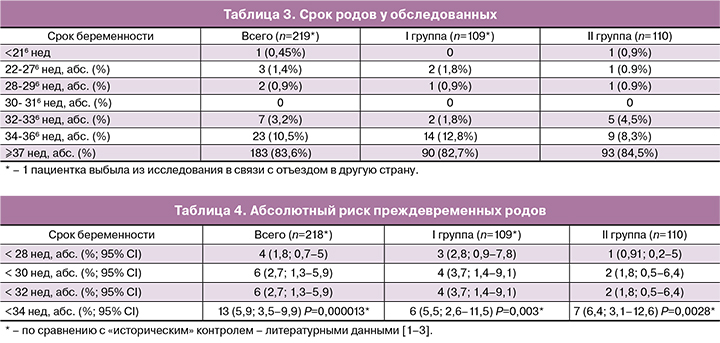
У подавляющего числа пациенток обеих групп роды были своевременными (табл. 3). Поздний выкидыш в 186 нед имел место в одном случае у пациентки из I группы с исходной длиной шейки матки по данным УЗИ, равной 1,8 см. Статистически значимых различий в частоте ПР по срокам беременности не отмечалось, частота до 34 нед беременности у пациенток высокого риска составила 5,5%
Согласно полученным результатам (табл. 4), при сравнении с литературными данными о частоте ПР среди женщин высокого риска статистически значимо низкий риск ПР до 34 нед беременности отмечался как в общей группе (Р=0,000013), так и отдельно по группам (P=0,003 и P=0,0028 соответственно).
Масса тела новорожденных составила 3123,7±667,6 г в I группе и 3184,5±698,6 г во II группе. Оценка состояния новорожденных по шкале Апгар на 1-й мин составила 8 баллов в обеих группах, на 5-й мин – 9 баллов в I группе и 8 баллов во II группе. Антенатальная гибель плода имела место в одном случае, интранатальная гибель плода – также в одном случае. В кислородной поддержке нуждались 17 (7,9%), терапию сурфактантом получили 5 (2,3%) новорожденных. Нейросонография была проведена 198 новорожденным, при этом отклонения от нормы отмечались в 4 (2,0%) случаях. Субэпендимальные кровоизлияния были диагностированы в двух случаях (0,9%), внутрижелудочковые – в одном (0,45%).
В общей группе относительный риск ПР в сравнении с литературными данными составил 0,22 (95% ДИ 0,12–0,4), снижение относительного риска – 0,78 (95% ДИ 0,61–0,88), отношение шансов – 0,17 (95% ДИ 0,09–0,31). Число пациенток, которых необходимо пролечить для предотвращения одного случая преждевременных родов, составило 5 (95% ДИ 4–7).
В I группе («короткая» шейка матки) относительный риск ПР в сравнении с литературными данными составил 0,22 (95% ДИ 0,1–0,48); снижение относительного риска – 0,8 (95% ДИ 0,52–0,9); отношение шансов 0,17 (95% ДИ 0,07–0,40). Число пациенток, которых необходимо пролечить для предотвращения одного случая преждевременных родов, составило 5 (95% ДИ 4–8).
Во II группе (группа с анамнестическими факторами риска) относительный риск ПР составил 0,22 (95% ДИ 0,1–0,48); снижение относительного риска – 0,78 (95% ДИ 0,52–0,9); отношение шансов 0,17 (95% ДИ 0,08–0,40). Число пациенток, которых необходимо пролечить для предотвращения одного случая преждевременных родов, составило 5 (95% ДИ 4–8).
Статистическая значимость снижения риска преждевременных родов до 34 недель беременности составила в общей группе 0,000013, в группе с укорочением шейки матки 0,003 и в группе с анамнестическими факторами риска 0,0028. Статистические различия между группами отсутствовали.
Обсуждение результатов
Несмотря на имеющиеся данные о целесообразности назначения вагинального прогестерона с профилактической целью беременным высокого риска (укорочение шейки матки по данным УЗИ в 18–20 нед беременности и/или ПР в анамнезе) при отсутствии клинических признаков угрожающих ПР, проведенное нами международное многоцентровое открытое исследование по эффективности и безопасности применения микронизированного прогестерона (утрожестана) также продемонстрировало статистически значимое снижение частоты ПР в сроке ≤34 нед беременности (5,9%; 95% CI (3,5–9,9; Р=0,000013) по сравнению с литературными данными, поскольку мы сознательно, из этических соображений не формировали группу сравнения и не подвергали беременных дополнительному риску, не назначая общепризнанной медикаментозной профилактики ПР прогестероном. В отдельных рандомизированных клинических исследованиях [5] было показано отсутствие влияния выявленного снижения частоты ПР в сроках ≤34 нед гестации у беременных с короткой шейкой матки на значительное улучшение неонатальных исходов. Согласно вторичному анализу рандомизированных клинических исследований, применение прогестерона у беременных с ПР в анамнезе [2] способствовало замедлению созревания шейки матки по мере прогрессирования беременности [5], снижению риска ПР, частоты поступления и менее длительному пребыванию новорожденных в палате интенсивной терапии [6–8]. В нашем исследовании отмечено закономерное снижение неонатальных осложнений, что выражалось в низкой частоте дыхательных расстройств (7,9%) и повреждений головного мозга в виде субэпендимальных и внутрижелудочковых кровоизлияний (1,35%).
Сильные стороны данного исследования. Проведено международное, многоцентровое, открытое исследование (III фаза) эффективности и безопасности микронизированного прогестерона для профилактики ПР у двух групп «асимптомных» женщин из группы риска: с короткой шейкой матки по данным УЗ-цервикометрии и/или ПР в анамнезе. Определены первичная и вторичная точки оценки эффективности терапии. Рассчитан абсолютный и относительный риск ПР для каждой группы. Полученные результаты согласуются с данными мета-анализа и систематических обзоров [9, 10].
Недостатки данного исследования. По этическим соображениям в данном исследовании отсутствовала контрольная группа (группа плацебо-контроля). Полученные результаты по снижению рисков (абсолютного и относительного) ПР сравнивались с общепризнанными данными литературы. В настоящее время наиболее простым предиктором ПР является наличие в анамнезе ПР, преждевременного разрыва плодных оболочек или спонтанного невынашивания во втором триместре беременности. Риск ПР в данной популяции составляет около 30% [1]. ПР в анамнезе как фактор риска неприменим в случае первой беременности. Нерожавших женщин группы высокого риска можно выявить при скрининговом ультразвуковом исследовании шейки матки во втором триместре (длина менее 25 мм). Риск ПР в данной популяции составляет около 25% [2].
Выводы
- На основании полученных данных можно сделать вывод об эффективном снижении риска преждевременных родов до 34 недель беременности при назначении микронизированного прогестерона по 200 мг (капсулы для вагинального применения) беременным с отсутствием клинических признаков угрозы прерывания беременности, но с преждевременными родами или преждевременным излитием околоплодных вод до 37 нед беременности в анамнезе или с укорочением шейки матки, выявленным при трансвагинальном УЗИ в 18–20 нед.
- Препарат микронизированного прогестерона 200 мг (утрожестан) продемонстрировал хорошую безопасность и переносимость.
Благодарности:
Научно-исследовательский институт акушерства и гинекологии им. Д.О. Отта Северо-Западного отделения РАН, Санкт-Петербург
Тарасова Марина Анатольевна
ФГБОУ ВПО Российский университет дружбы народов, кафедра акушерства и гинекологии с курсом перинатологии, Москва
Радзинский Виктор Евсеевич
ГУЗ Московский областной научно-исследовательский институт акушерства и гинекологии, Москва
Логутова Лидия Сергеевна
ГБОУ ДПО Российская медицинская академия последипломного образования Минздрава России, Москва
Подзолкова Наталия Михайловна
ГБОУ ВПО Кемеровская государственная медицинская академия Минздрава России, г. Кемерово
Артымук Наталья Владимировна
Днепропетровский городской родильный дом № 1, женская консультация, г. Днепропетровск, кафедра акушерства и гинекологии ДМА
Проф. В.А. Потапов
Центральная городская клиническая больница № 6, Родильный дом № 6, г. Донецк, кафедра акушерства, гинекологии и перинатологии № 2 ДГМУ
Проф. В.М. Астахов
Городской родильный дом № 1, г. Симферополь, кафедра акушерства и гинекологии № 1 КГМУ
Проф. В.А. Заболотнов
Центральная районная поликлиника Печерского района г. Киева, женская консультация № 1
Н.Ю. Волкова
Киевский городской родильный дом № 6, Центр здоровья женщины, кафедра акушерства и гинекологии № 2 НМУ
Проф. Е.П. Гнатко
Ивано-Франковский областной перинатальний центр, отделение акушерской патологии, кафедра акушерства и гинекологии Ивано-Франковского НМУ
Проф. О.М. Макарчук
УЗ Городской родильный дом № 3 г. Запорожье, женская консультация
Проф. Н.С. Луценко
УЗ 1-я городская клиническая больница, г. Минск
Проф. Л.Ф. Можейко



