Непрерывный контроль качества производства вакцинных препаратов является основой безопасности их применения в практике здравоохранения. Использование вакцин в период беременности диктует необходимость изучения их влияния не только на организм привитой, но и на течение беременности, развитие плода и состояние здоровья новорожденных. Именно недостаточность знаний в изучении действия вакцин, а также информативности о бремени гриппа препятствуют осуществлению программы иммунизации беременных во всем мире.
История применения инактивированных вакцин против гриппа у беременных датирована концом 1950-х – началом 1960-х годов. Проведенные исследования с использованием инактивированных вакцин не выявили их неблагоприятного влияния на течение беременности и развитие ребенка [1–3]. Это подтвердили и современные исследования [4, 5].
Последняя пандемия гриппа, вызванная вирусом A(H1N1), продиктовала необходимость разработки новых вакцинных препаратов, содержащих адъюванты MF-59 и AS03, позволяющих ускорить интенсивность антителообразования в короткие сроки. Несмотря на безопасность применения этих вакцин в популяции, у беременных отмечено незначительное повышение реактогенности с недоказанным тератогенным или другим отрицательным влиянием на исход беременности [6–11]. В Российской Федерации в производстве вакцинных препаратов против гриппа семейства гриппол используется особая технология комплексирования высоко очищенных протективных антигенов вируса гриппа с полимерным водорастворимым высокомолекулярным иммуноадъювантом полиоксидонием. Эти вакцины применяются как у взрослых, так и у детей c 6 месячного возраста. У беременных на практике ранее не использовали данные вакцины, хотя экспериментально было доказано отсутствие побочных эффектов.
Целью исследования явилось изучение клинической и иммунологической безопасности вакцин против гриппа у беременных, исхода беременности.
Материал и методы исследования
В слепом плацебо-контролируемом исследовании находилось 137 женщин во II и III триместрах физиологически протекающей беременности с рандомизацией на клинические группы. I группа – 43 беременных вакцинированных моновалентной отечественной субъединичной адъювантной вакциной моногриппол плюс (штамм А/H1N1v 5 мкг, 500 мкг Полиоксидония), II группа – 50 беременных, привитых трехвалентной субъединичной адъювантной вакциной гриппол плюс (по 5 мкг штаммов А/H1N1v, H3N2 и В, 500 мкг полиоксидония, ООО ФК «Петровакс», Россия), III группа – 44 беременных, вакцинированных коммерческой трехвалентной субъединичной вакциной агриппал S1, содержащей по 15 мкг вышеуказанных 3 штаммов антигенов (Novartis Vaccines and Diagnostics, Италия). После подписания информированного согласия на участие в клиническом исследовании, беременные были вакцинированы однократно, внутримышечно, в дозе 0,5 мл, согласно инструкции по применению препарата. Вакцины, применяемые в 2009–2010 гг. и 2010–2011 гг., имели одинаковый эпидемический состав штаммов вируса гриппа. Группу контроля составила 41 беременная, получившие препарат плацебо (фосфатно-солевой буфер, применяющийся для разведения лиофилизированных вакцин). Осмотр перед вакцинацией и дальнейшее клиническое наблюдение за женщинами на весь период беременности проводились акушером-гинекологом в соответствии с требованиями Приказа Минздравсоцразвития РФ от 02.10.2009 № 808н «Об утверждении порядка оказания акушерско-гинекологической помощи» и в соответствии с положениями Европейского центра по профилактике и контролю заболеваний (ECDC).
Вакцинация беременных проводилась при соблюдении этических норм и рекомендаций ВОЗ и Министерства здравоохранения РФ. Женщины, подлежащие вакцинации и последующему наблюдению, отбирались строго в соответствии с индивидуальной регистрационной картой, рассмотренной и утвержденной Этическим комитетом Института медицины, экологии и физической культуры Ульяновского государственного университета. Все кандидаты на участие в программе исследования предварительно оценивались по критериям включения и исключения из протокола (по стандартам (GMP).
Поствакцинальные системные и местные реакции на вакцинные препараты регистрировались в течение 30 дней с момента введения препарата.
Общеклинические методы исследования беременных включали оценку общего состояния их здоровья в момент обследования и анамнестические данные об инфекционных и соматических заболеваниях. Беременные с признаками акушерской патологии, дефицитными анемиями и активными формами хронических урогенитальных инфекций, имевшие в анамнезе случаи невынашивания или мертворождения, рождения детей с отклонениями или пороками развития исключались из исследования.
Биохимический анализ крови (креатинин, мочевина, аланинаминотрансфераза аспарагинаминотрасфераза, лактатдегидрогеназа, общий белок, щелочная фосфатаза), данных липидограммы (холестерин общий, триглицериды, коэффициент атерогенности, липополисахариды высокой плотности, липополисахариды низкой плотности), проводились всем беременным по общепринятой методике.
Гормональный статус женщин во время беременности оценивался по уровню сывороточных гормонов – прогестерона, пролактина и кортизона с использованием иммуноферментного анализа (ИФА) (ООО «Компания Алкор Био», Россия), а эстрадиола – с применением тест-системы «Эстрадиол-ИФА» (ООО «Хема», Германия), основанной на использовании классического варианта конкурентного ИФА.
В рамках иммунологического анализа изучалось функционирование системы цитокинов, как одного из ключевых механизмов, определяющих ход иммунных реакций и участвующих в сохранении или дестабилизации иммунного гомеостаза. Данные иммунные белки условно подразделяли на 2 группы: провоспалительную – интерлейкин-1α (ИЛ1α), интерлейкин-2 (ИЛ2), интерферон-γ (ИНФγ), фактор некроза опухоли-α (ФНОα) и противовоспалительную – рецепторный антагонист интерлейкина-1α (ИЛ1РА), интерлейкин-10 (ИЛ10). Определение цитокинов проводилось в двойном тесте: спонтанном и стимулированном с использованием коммерческих тест-систем ИФА (ЗАО «Вектор-Бест» и ООО «Цитокин», Россия).
Концентрация сывороточных иммуноглобулинов основных классов А, М, G, IgG1, IgG2, IgG3, IgG4, E определялась с помощью стандартных тест-систем ИФА (ЗАО «Вектор-Бест»).
Статистическую обработку данных проводили с помощью программы AtteStat 10.2.0, интегрированной в среду Excel (2003) с использованием параметрических и непараметрических методов статистики. При анализе полученных результатов определяли средние величины и стандартную ошибку (M±m). Достоверность полученных результатов оценивали при уровне p<0,05.
Результаты и обсуждение
Клиническая переносимость вакцинации
Сравнивая поствакцинальный период у беременных, привитых разными вакцинными препаратами, выявлено, что женщины, у которых полностью отсутствовали какие-либо жалобы на протяжении 30 суток, встречались с сопоставимой частотой во всех группах наблюдения, не превышая таковую в группе плацебо (p>0,05) (табл. 1).
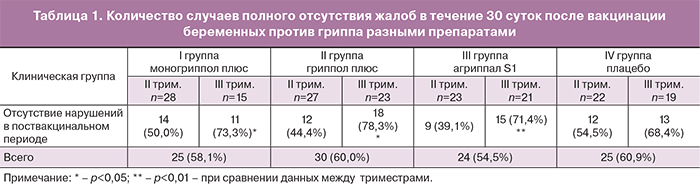
Полученные данные свидетельствуют о благоприятном течении поствакцинального периода. Детальный анализ клинического состояния женщин в течение первых 7 суток после введения препарата показал, что у беременных всех групп наблюдалась схожая частота зарегистрированных системных (общих) реакций, то есть взаимосвязь между частотой развития системных реакций и введением различных вакцинных препаратов не выявлена. Такие симптомы как головокружение регистрировались с меньшей частотой (6,%) в группе беременных, вакцинированных препаратом моногриппол плюс, по сравнению с получившими трехвалентную вакцину гриппол плюс (18,9%). В то же время эти симптомы не могут быть связаны с антигенной нагрузкой одной прививочной дозы препарата, поскольку такая же реакция отмечалась и у беременных из группы плацебо (12,9%). Среди привитых регистрировались единичные случаи миалгий, однако связать их появление с введением трехвалентной гриппозной вакцины, как отечественного (8,1%), так и зарубежного (2,6%) производства, не представлялось возможным, так как такие же жалобы встречались и у беременных из группы плацебо (9,6%). Местные реакции (уплотнение) на введение вакцин против гриппа возникали у беременных, получавших как моно- (4,7%), так и трехвалентные вакцины (8–9%), что достоверно (p<0,05) отличалось от беременных группы плацебо (2,4%). Такие симптомы, как боль, гиперемия и уплотнение в месте введения вакцины сохранялись 1,5–2,5 суток и проходили самостоятельно без назначения лекарственных препаратов.
Наблюдение за беременными с 8-х по 30-е сутки поствакцинального периода указало на повышение температуры среди всех вакцинируемых (в том числе в группе плацебо), которое было связано с присоединением респираторной инфекции легкого и среднего клинического течения (11,6–20,5%). Другие системные реакции – повышенная утомляемость, артралгии, миалгии, головная боль, головокружение, боли в животе, диарея – не имели связи с вводимым ранее вакцинным препаратом и встречались с одинаковой частотой (I группа – 9,3%, II группа – 14,0%, III группа – 12,5%, IV группа – 12,2%) у всех привитых беременных, не нуждающихся в назначении какой-либо терапии.
В анамнезе акушерского наблюдения в течение 30 дней после проведения вакцинации во всех группах наблюдения клинически не зарегистрированы случаи острой угрозы прерывания беременности и последующего учащения инфекционной заболеваемости.
Анализ лабораторных данных
Параметры биохимического анализа крови каждой из изучаемых групп наблюдения в динамике 7 и 30 суток поствакцинального периода не имели выраженных сдвигов, отражающих нарушения в системе метаболического гомеостаза.
В то же время, при сравнении изучаемых показателей в зависимости от применявшихся у беременных вакцин, выявлено, что только в двух позициях имелись достоверные различия. Наименьший уровень креатинина сыворотки крови через 30 суток после проведения вакцинации регистрировался у беременных, получивших агриппал S1 (58,04±1,57 мкмоль/л – III группа, против 62,56±1,92 мкмоль/л – I группа и 60,10±1,15 мкмоль/л – II группа) – p<0,05. В те же сроки наблюдения, уровень щелочной фосфатазы наоборот был наивысшим в III группе (86,23±7,84 МЕ/л), что значимо отличалось от беременных c моновалентной вакцинацией (64,16±3,84 МЕ/л), p<0,01.
Сравнительный анализ данных липидограммы (холестерин общий, триглицериды, коэффициент атерогенности, липополисахариды высокой плотности, липополисахариды низкой плотности, липополисахариды очень низкой плотности) показал, что в целом, полученные значения в динамике поствакцинального периода существенно не различаются по группам наблюдения. Исключение составляет содержание общего холестерина, который у беременных, привитых препаратом агриппал S1 был несколько ниже (4,36±0,17 моль/л), чем в группах женщин, привитых вакцинами семейства гриппол плюс: 4,93±0,13 моль/л – I группа (p<0,01) и 4,84±0,13 моль/л – II группа (p<0,05). Несмотря на эту разницу, все описываемые результаты не выходят за границы физиологической нормы, что отражает отсутствие негативного влияния вакцинации на общий липидный обмен у беременных.
При сопоставлении данных содержания гормонов (пролактин, прогестерон, кортизол, эстрадиол) в сыворотке крови беременных, вакцинированных разными препаратами, было показано, что все изучаемые параметры не отличались между группами наблюдения внутри одного и того же периода обследования. Следовательно, можно подчеркнуть, что, несмотря на некоторые различия в составе применяемых вакцин против гриппа, в периоде активного формирования поствакцинального иммунитета не происходит изменений в содержании основных гормонов беременности.
Сравнительный анализ содержания иммуноглобулинов сыворотки крови беременных (IgA, IgM, IgG, IgG1, IgG2, IgG3, IgG4, IgE), получивших разные вакцины против гриппа показал, что в целом, исходно и через 7 дней после прививки отмечалось сопоставимое количество данных белков. Через 30 дней у беременных, получивших моновалентную вакцину против гриппа, наблюдали более высокий уровень IgA (2,56±0,27 мг/мл) по сравнению с женщинами, привитыми трёхвалентными препаратами (1,61±0,09 мг/мл – II группа и 1,34±0,11 мг/мл – III группа) – p<0,01 и p<0,001 соответственно. По содержанию IgM, IgG и IgE различий между группами сравнения не выявлено. Через 30 дней после вакцинации регистрировалось умеренное повышение IgG1-изотипа у беременных III группы (13,49±1,10 мг/мл; p<0,01 к группам I и II). Относительно увеличенным в I группе был уровень IgG2-изотипа (7,45±0,78 мг/мл; p<0,05 к III группе). Изначально повышенное количество IgG3-изотипа в I группе (1,37±0,17 мг/мл; p<0,05 к II группе) в последующие периоды наблюдения выравнивалось до средних значений смежных групп. Показатели IgG4-изотипа различались только во II группе (0,87±0,08 мг/мл) через 30 дней после проведения вакцинации (p<0,01 к I группе). Корреляционной зависимости выявленных изменений с уровнем основных классов иммуноглобулинов, гормонов сопровождения беременности выявить не удалось. Следует подчеркнуть, что хотя и наблюдались относительные различия между группами сравнения в показателях иммуноглобулинов, данное звено гуморального иммунитета в динамике поствакцинального периода, в целом, не имело изменений.
Сравнительный анализ состояния цитокинов (ИЛ1α, ИЛ2, ФНОα спонтанных и стимулированных) у беременных, вакцинированных разными препаратами показал, что достоверных различий между исследуемыми клиническими группами в динамике наблюдения по содержанию ИЛ1a и ИЛ2 не зарегистрировано. В то же время отмечена относительно повышенная продукция ФНОα лейкоцитами крови в тесте с митогеном через 30 дней у беременных III группы по сравнению с результатами I группы (p<0,05).
Сравнительные данные по цитокинам (ИЛ1РА, ИЛ4, ИЛ10, ИНФγ, спонтанные и стимулированные) с регуляторной активностью свидетельствуют о различиях в содержании спонтанного ИЛ1РА через 7 и 30 дней после вакцинации. Так, наибольший уровень исследуемого белка в раннем поствакцинальном периоде приходился на группу, привитых против гриппа препаратом гриппол плюс (1112,30±83,64 пг/мл), в сравнении с значениями I группы (689,86±70,39 пг/мл; p<0,001) и III группы – 728,64±67,68 пг/мл; p<0,01). Через 30 дней контроля относительно высокие значения этого цитокина, помимо II группы (1227,80±98,71 пг/мл), наблюдались и в III группе (1039,80±78,47 пг/мл), которые достоверно различались с показателями беременных, получивших моновалентную противогриппозную вакцину (748,75±69,25 пг/мл) – p<0,001; p<0,01, соответственно.
В стимулированном тесте, напротив, никаких достоверных различий количества ИЛ1РА в динамике поствакцинального периода не зафиксировано. Такая же ситуация прослеживалась и при анализе спонтанного уровня ИЛ4 (p>0,05). В то же время, после митогенстимуляции, содержание этого белка значительно повышалось в раннем поствакцинальном периоде (5,82±1,36 пг/мл), что значимо отличалось от показателя, полученного в I группе (87±0,13 пг/мл) – p<0,01. Уровень ИЛ10 в обоих тестах не отличался между группами сравнения. Концентрация спонтанного ИНФγ через 7 дней контроля у беременных, привитых препаратами моногриппол плюс (6,47±1,68 пг/мл) и гриппол плюс (5,89±1,08 пг/мл) была выше, чем в группе вакцинации агриппал S1 (3,03±0,39 пг/мл) – p<0,01; p<0,05 соответственно.
Таким образом, картина цитокинового профиля обследуемых женщин в целом имела тенденцию, свойственную механизмам физиологической иммуносупрессии при беременности. Тем не менее, иммуноадъювантные субъединичные вакцины имели некоторые сравнительные отличия по способности влиять на секрецию цитокинов: кратковременное повышение количества ИНФγ наиболее ярко просматриваемое у беременных II триместра гестации, что возможно, характеризует активное вовлечение в поствакцинальный иммунный ответ Th1-опосредованных механизмов. Со стороны безадъювантного аналога в раннем поствакцинальном периоде замечены процессы в иммунной системе, сопровождающиеся повышенным синтезом лейкоцитов крови ИЛ4 (признак Th2-зависимой активации), особенно у женщин, привитых в поздние сроки беременности. Косвенным подтверждением данного предположения является отсутствие у них существенных сдвигов со стороны уровня ИНФg в раннем и позднем поствакцинальном периодах. Все обнаруженные сдвиги показателей регистрируемых в разных группах привитых, не выходили за границы допустимых порогов нормы.

Исходы беременности
В большинстве случаев (85,4–90,7%) в группах наблюдения беременность завершились физиологическими родами (табл. 2).
При этом у части женщин беременность закончилась преждевременно, с рождением недоношенных детей (от 2,0 до 8,3%), что совпадает с частотой данного показателя, регистрируемого по Ульяновскому региону (3,7–5,8%), где осуществлялась вакцинация. Такой исход был обусловлен акушерской патологией, которая не имела связи с проведенной ранее вакцинацией.
Заключение
Таким образом, использование современных отечественных вакцин против гриппа моногриппол плюс и гриппол плюс, имеющих в своем составе иммуноадъювант полиоксидоний, показало клиническую безопасность, характеризующуюся отсутствием развития необычных явлений у беременных во II и III триместрах беременности в поствакцинальном периоде. Рекомендуемый перечень лабораторных исследований, соответствующий Национальному стандарту Российской Федерации и международной практике клинических исследований (GCP) – биохимия крови, основные классы иммуноглобулинов, расширенный в данной работе исследованиями липидограммы, гормонов беременности, изотипов IgG, провоспалительных и противовоспалительных цитокинов, не выявил изменений, характеризующих дестабилизацию в регулировании и функционировании иммунной системы.
Утвержденный Национальный календарь профилактических прививок (2014) с новым дополнением по вакцинации беременных против гриппа, изданные Федеральные клинические рекомендации «Вакцинация беременных против гриппа» (2015 г.) и вышеизложенная информация позволят врачам общей практики и особенно акушерам-гинекологам, использовать вакцинацию против гриппа у беременных как одно из приоритетных направлений профилактической медицины [12, 13].



