Снижение потенциала здоровья, наблюдаемое в современной популяции подростков и молодежи, отражается на функциональном состоянии репродуктивной системы. Качественно неполноценное питание [1, 2], значительные психологические и умственные нагрузки создают фон для развития гипоталамо-гипофизарной дисфункции, нарушения метаболизма стероидных гормонов, процесса овуляции и функции желтого тела [1, 3].
Расстройства менструального цикла являются частой проблемой подросткового и раннего репродуктивного возраста. Распространенность дисменореи в этой возрастной категории достигает 60–90%, нарушения длительности менструального цикла персистируют от 3 до 5 лет у 10–15% подростков, высока также частота меноррагии (10–20%), ациклических кровотечений и олигоменореи [4–6]. Среди причин этих расстройств у подростков и молодых женщин рассматривают гиперандрогенизм, стрессовое воздействие, потерю массы тела, расстройства пищевого поведения, преждевременную недостаточность яичников и другие, функциональные и органические заболевания и состояния. Несмотря на высокую распространенность нарушений менструального цикла, всего 6–15% подростков обращаются к врачу, а среди молодых женщин обращаемость увеличивается только за счет присоединения проблемы бесплодия. Между тем нарушения менструального цикла несут в себе риск последующих репродуктивных расстройств, и поэтому их необходимо лечить.
 Терапия нарушений менструального цикла у молодых пациенток предоставляет непростую задачу. Незрелость эндокринной регуляции и механизмов обратной связи требует бережного, щадящего вмешательства, в связи с чем применение гормональной терапии ограничивается, и в отсутствии сформировавшихся хронических нарушений или эндокринопатий рекомендуется регулирующая негормональная терапия.
Терапия нарушений менструального цикла у молодых пациенток предоставляет непростую задачу. Незрелость эндокринной регуляции и механизмов обратной связи требует бережного, щадящего вмешательства, в связи с чем применение гормональной терапии ограничивается, и в отсутствии сформировавшихся хронических нарушений или эндокринопатий рекомендуется регулирующая негормональная терапия.
В гинекологической практике много лет используются негормональные лекарственные препараты, созданные на основе Vitex agnus castus (витекс священный, или прутняк) и оказывающие дофаминергическое действие благодаря стимуляции в лактотрофных клетках гипофиза D2-дофаминовых рецепторов. Современные препараты, содержащие Vitex agnus castus, мастодинон и циклодинон, применяются при функциональной гиперпролактинемии, масталгии, нарушениях менструального цикла, предменструальном синдроме, дисменорее [7–9]. Препарат циклодинон устраняет избыточную секрецию пролактина, нормализует уровень половых гормонов, корректирует овуляторные расстройства, устраняет или смягчает выраженность масталгии и других болевых симптомов. Целью настоящего исследования стало изучение клинической эффективности растительного лекарственного препарата циклодинон в лечении подростков и молодых женщин с функциональными нарушениями менструального цикла.
Материал и методы исследования
В исследование были включены 80 подростков и молодых женщин, соответствующие следующим критериям: возраст от 16 до 26 лет; нарушения менструального цикла – аменорея (отсутствие менструаций в течение 3 месяцев при предшествующем регулярном ритме менструаций), олигоменорея (увеличение продолжительности цикла более 37 дней), полименорея (межменструальные интервалы менее 24 дней), межменструальные кровотечения/кровомазанье; нормогонадотропный статус; уровень пролактина более 250 мМЕ/л; продолжительность текущего эпизода нарушений менструального цикла не более 6 месяцев; информированное согласие на участие в исследовании.
В исследование не включались женщины при наличии следующих критериев: стойкие (хронические) нарушения менструального цикла длительностью более 6 месяцев; гипогонадотропная и гипергонадотропная аменорея; уровень пролактина ниже 250 мМЕ/л; эндокринопатии (синдром поликистозных яичников, синдром гиперпролактинемии и др.); хронические соматические, нервные и психические заболевания; нарушения менструального цикла в результате структурной патологии матки (миома матки, аденомиоз, гиперплазия и полип эндометрия); заболевания молочной железы, требующие хирургического лечения; применение гормональной терапии в течение 3 месяцев до начала исследования; отказ от участия в исследовании.
На этапе скрининга проводилось комплексное клинико-лабораторное обследование больных, включавшее изучение анамнестических данных, характеристик менструального цикла, общий физикальный осмотр, осмотр молочных желез, гинекологическое исследование, проводилось общеклиническое лабораторное обследование, ультразвуковое исследование (УЗИ) органов малого таза и молочных желез, исследование уровней половых и стероидных гормонов. По показаниям лабораторно-инструментальное обследование расширялось в зависимости от выявленных отклонений.
После первичного скрининга проводилась рандомизация методом случайных чисел в две группы. Пациентки основной группы получали циклодинон таблетки ежедневно один раз в сутки. Пациентки группы сравнения получали мультивитаминный комплекс (МВК) ежедневно один раз в сутки. Лечение проводилось в течение 6 месяцев. Сексуально активные женщины во время проведения исследования применяли барьерную контрацепцию.
На промежуточном этапе (через 3 месяца терапии) и при ее окончании оценивались следующие клинические параметры: продолжительность менструального цикла, частота и продолжительность аномальных кровяных выделений, интенсивность боли в молочных железах. Клинические характеристики менструального цикла оценивали на основании анализа менструальных календарей, которые участницы вели самостоятельно на протяжении всего периода исследования. Выраженность масталгии оценивали по визуально-аналоговой шкале (ВАШ), градуированной от 0 до 10 баллов. Характер расстройства овуляции устанавливали при динамическом проведении УЗИ органов малого таза, а также на основании оценки уровня прогестерона. Также определяли содержание пролактина в плазме крови 3 раза с интервалом в неделю на этапе скрининга и в завершение терапии. Вегетативный статус анализировали при помощи «Вопросника для выявления признаков вегетативных изменений» (Вейн А.М., 1998) состоящего из двух частей, которые заполняет пациент (1-я часть) и врач (2-я часть).
 Результаты опроса и осмотра интерпретировались как «норма», «вегетативная лабильность» или «синдром вегетативной дисфункции» в зависимости от количества набранных баллов. Оценка качества сна проводилась на основании «Анкеты балльной оценки субъективных характеристик сна». Снижение числа баллов согласно этому опроснику интерпретируется как признак расстройств сна.
Результаты опроса и осмотра интерпретировались как «норма», «вегетативная лабильность» или «синдром вегетативной дисфункции» в зависимости от количества набранных баллов. Оценка качества сна проводилась на основании «Анкеты балльной оценки субъективных характеристик сна». Снижение числа баллов согласно этому опроснику интерпретируется как признак расстройств сна.
Статистическую обработку результатов исследования проводили на персональном компьютере с помощью пакета стандартных программ Microsoft Exel, Biostat, Statistica 6.0 for Windows. Для каждого показателя, измеряемого по количественной шкале, определялись среднее значение (М), стандартная ошибка (m) и отклонение (σ), интервал вариации (минимум и максимум). Для качественных параметров частоту выявления определяли показателем, выраженным в процентах (%). Сравнительный анализ показателей эффективности (количественные переменные) проводился путем сравнения средних величин в основной и контрольной группах с применением U-критерия Манна–Уитни, критерия Вилкоксона (непараметрическая статистика) или t-критерия Стьюдента (при нормальном распределении). Сравнение качественных параметров осуществлялся методом χ2. Достоверными различия меду группами больных принимались при уровне значимости 0,05.
Результаты исследования
С учетом вероятного отсева в процессе проведения исследования скрининг прошли 88 пациенток. В процессе проведения исследования из него были исключены 8 пациенток: 1 в группе лечения, 7 – в группе контроля. Причиной исключения 1 пациентки в группе лечения было несоблюдение протокола исследования (отсутствие мер по контрацепции) и наступление беременности. В группе контроля 1 пациентка была исключена из исследования из-за несоблюдения ежедневного режима приема МВК, 1 – в связи с аллергической реакцией, 5 отказались от продолжения приема МВК из-за отсутствия ожидаемого лечебного эффекта. При выбывании пациенток из исследования проводился дополнительный набор участниц. Таким образом, в окончательный анализ были включены полностью завершившие исследование 80 подростков и молодых женщин с нарушениями менструального цикла. Возраст участниц исследования колебался от 16 до 26 лет (средний возраст 22,7±4,3 года), из них 14 (17,5%) были в возрасте 16–19 лет и 66 (82,5%) в возрасте 20–26 лет.
Обследование не выявило серьезных отклонений здоровья у подростков и молодых женщин, включенных в исследование. Транзиторные подъемы артериального давления наблюдались у 6 (7,5%) пациенток. У 7 (8,75%) пациенток было зафиксировано диффузное увеличение щитовидной железы при отсутствии признаков нарушения функции.
Нарушения менструального цикла носили гипоменструальный характер у 56 (70%) пациенток, из которых у 49 (61,25%) наблюдалась олигоменорея, и у 7 (8,75%) – аменорея. Жалобы на частые менструации (полименорея) предъявляли 4 (5%) пациентки, у 20 (25%) ритм менструаций был сохранен, но при этом наблюдались межменструальные (2 (10%)) или предменструальные (18 (90%)) кровяные выделения. Также межменструальное кровомазанье было отмечено у 13 (26,53%) и предменструальное кровомазанье у 9 (18,37%) пациенток с олигоменореей.
При первичном скрининге УЗИ и динамическое определение уровня прогестерона позволили выявить признаки овуляции у 6 (7,5%) пациенток, среди которых у 1 наблюдалась олигоменорея и у 5 – регулярный менструальный цикл с предменструальным кровомазаньем. У 8 (10%) женщин были обнаружены ретенционные кисты яичника. Персистенция фолликула наблюдалась у 9 (11,25%) женщин, из них 4 имели регулярный ритм менструаций, 4 – нарушения цикла по типу полименореи, 1 – по типу олигоменореи. У остальных пациенток при УЗИ были выявлены мелкокистозные изменения яичников (МКЯ).
При опросе и осмотре симптомы нарушений состояния молочных желез были обнаружены у 48 (60%) пациенток: масталгия перед менструальным кровотечением в 39 (48,75%) наблюдениях и галакторея в 16 (20%) наблюдениях. Циклическая масталгия встречалась у всех женщин с регулярным менструальным циклом и полименореей, а также у 15 (30,6%) пациенток с нарушениями цикла по типу олигоменореи. Галакторея, напротив, была выявлена при осмотре только у больных с олигоменореей/аменореей: в 5 (71,43%) наблюдениях при аменорее, в 11 (22,45%) наблюдениях при олигоменорее, сочетаясь с циклической масталгией у 7 (14,29%) пациенток. Выраженность масталгии по ВАШ составила, в среднем, 5,22±1,6 балла.
Средний уровень пролактина составил 579,6 мМЕ/л, транзиторное повышение уровня пролактина с его спонтанной нормализацией в течение 2 недель отмечалось у 28 (35%), стойкая истинная гиперпролактинемия (ГПРЛ) (максимальный уровень пролактина 922 мМЕ/л) – у 11 (13,75%), макропролактинемия (макроПРЛ) – 21 (26,25%). У 10 (12,5%) женщин повышения пролактина выявлено не было. Взаимосвязи между клиническими характеристиками и особенностями секреции пролактина нам установить не удалось.
Характеристики группы исследования и группы сравнения после рандомизации представлены в табл. 1.
Существенных отличий, которые могли бы повлиять на исход терапии, между пациентками двух групп обнаружено не было.
После окончания лечебного цикла, составившего 6 месяцев ежедневного приема циклодинона или МВК, мы проанализировали динамику клинических характеристик менструального цикла в процессе терапии.
 Среди 7 пациенток с исходной аменореей спонтанные менструации в течение 3 первых месяцев терапии появились у 5 больных: 3 – в группе «циклодинон», 2 – в группе контроля. У 2 пациенток группы контроля длительность отсутствия менструаций достигла 6 месяцев, и они досрочно завершили исследование. Средний межменструальный интервал в группе «циклодинон» составил 90,14 дня, в группе контроля – 54,5 дня. Ввиду малого числа наблюдений интерпретировать эти данные сложно.
Среди 7 пациенток с исходной аменореей спонтанные менструации в течение 3 первых месяцев терапии появились у 5 больных: 3 – в группе «циклодинон», 2 – в группе контроля. У 2 пациенток группы контроля длительность отсутствия менструаций достигла 6 месяцев, и они досрочно завершили исследование. Средний межменструальный интервал в группе «циклодинон» составил 90,14 дня, в группе контроля – 54,5 дня. Ввиду малого числа наблюдений интерпретировать эти данные сложно.
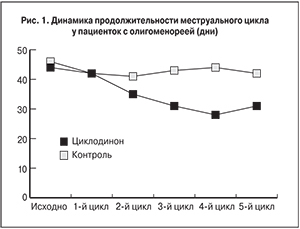
У пациенток с исходной олигоменореей величина межменструальных интервалов в группах существенно не различалась и составила в основной группе 44,34±5,92 дня, а в группе контроля – 46,02±9,17 дня (рис. 1). В результате терапии у больных, принимавших МВК, продолжительность цикла сократилась на 4 дня, составив в итоге 42,51±2,21 дня. У пациенток, принимавших циклодинон, продолжительность менструального цикла сократилась на 13 дней, составив в итоге 31,79±2,86 дня (р<0,001). Межгрупповые отличия по средней длительности заключительного оцениваемого менструального цикла были достоверны (р<0,001).
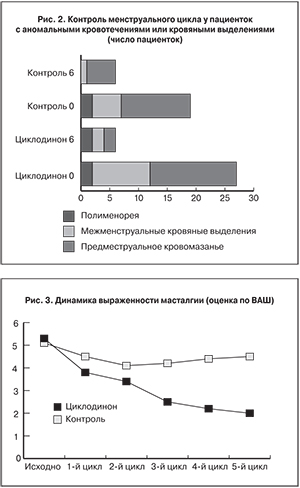
Вместе с коррекцией длительности менструального цикла у больных с олигоменореей и метроррагиями наблюдалось исчезновение эпизодов межменструального и предменструального кровомазанья (рис. 2). Однако у пациенток с регулярными менструациями циклодинон оказывал положительное влияние на контроль аномальных кровяных выделений только в половине случаев. При полименорее циклодинон был неэффективен, хотя малое число наблюдений не позволяет делать выводы в отношении циклодинона, как и в отношении МВК, при использовании которого наблюдалось удлинение межменструальных промежутков у пациенток с полименореей. У больных с метроррагиями применение МВК имело положительный эффект по контролю цикла у больных с регулярным ритмом менструаций, и этот эффект был сравним с таковым при использовании циклодинона.
Оценка характеристик овариальной функции в заключительном цикле исследования показало следующие результаты. Ановуляция с МКЯ сохранилась у 4 (10%) пациенток, принимавших циклодинон (3 из них с исходной аменореей). Эти данные отражают статистически значимое улучшение по сравнению с исходным статусом (р<0,001). В группе контроля данный тип ановуляторных нарушений сохранился у 13 (32,5%) больных, что недостоверно меньше по сравнению с исходными данными в группе, но достоверно больше по сравнению с группой «циклодинон» (р<0,001). Персистенция фолликула в заключительном цикле терапии была обнаружена у 8 (20%) пациенток основной и 10 (25%) – контрольной группы. Ретенционные кисты яичников были выявлены в группе контроля в 3 (7,5%) случаях, все они были представлены фолликулярными кистами. Таким образом, ановуляторные нарушения сохранились у 12 (30%) женщин против исходных 34 (85%), принимавших циклодинон (р<0,001), и у 26 (65%) пациенток против исходных 33 (82,5%), принимавших МВК (р>0,05), межгрупповые отличия по частоте ановуляции были достоверны (р<0,05).
Галакторея сохранилась у 3 (7,5%) из 10 пациенток, принимавших циклодинон, и 4 (10%) из 6 пациенток, принимавших МВК. У всех 7 больных с сохранившейся галактореей отсутствовал ответ на терапию в виде нормализации ритма менструации. Полное исчезновение боли в молочных железах отметили 5 (12,5%) пациенток группы «циклодинон» и 1 (2,5%) женщина группы контроля. Но при этом оценка выраженности боли по ВАШ демонстрировала у 14 (73,68%) из 19 пациенток, принимавших циклодинон, существенное ее облегчение и уход в зону «1–3» балла, что при качественной интерпретации ВАШ принято расценивать как отсутствие симптома.
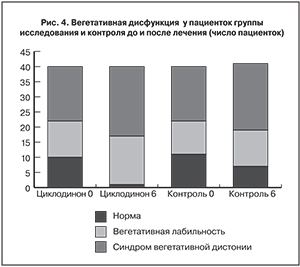
При оценке выраженности масталгии (рис. 3) мы видели положительную динамику в обеих группах, но более существенную в группе «циклодинон», на протяжении первых двух циклов наблюдения.
В дальнейшем выраженность масталгии в группе контроля незначительно нарастала, а в основной группе продолжила снижаться. В результате пациентки, принимавшие МВК, оценили в исходе лечения на 4,55±1,8 балла (без достоверной разницы по сравнению с исходным показателем), а пациентки, принимавшие циклодинон – 2,45±1,8 балла, что достоверно меньше, как по сравнению с исходным показателем (р<0,001), так и с группой контроля (р<0,001).
В заключительном цикле лечения мы трехкратно определяли уровни пролактина и макропролактина в плазме крови исследуемых женщин и сравнивали их с исходными показателями. Средний уровень пролактина снизился с 597,9±60,31 до 482,2±34,2 мМЕ/л в основной группе (р<0,001) и с 574,5±46,2 до 522,2±48 мМЕ/л (р>0,05) в группе контроля. В группе контроля доля пациенток с гиперпролактинемией сократилась с 15 до 10%, транзиторное повышение уровня пролактина наблюдалось в 6 (15%) случаях по сравнению с 13 (32,5%) исходными, частота встречаемости макропролактинемии не изменилась. В группе «циклодинон» наблюдалась полная нормализация секреции пролактина – признаки стойкого, или транзиторного повышения уровня пролактина, или макропролактинемии отсутствовали.
При анализе симптомов вегетативной дисфункции мы обнаружили сходное и несущественное повышение доли лиц с нормальным вегетативным статусом в обеих группах (рис. 4). Отличия касались только доли пациенток с синдромом вегетативной дистонии: в группе «циклодинон» этот показатель уменьшился с 25 до 2,5% (р<0,001), а в группе контроля – с 27,5 до 17,5%, с достоверной межгрупповой разницей по частоте встречаемости СВД (р<0,001).
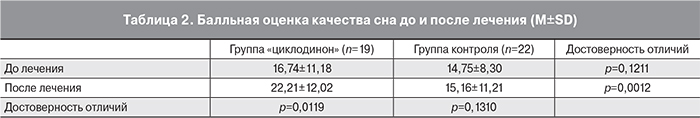
Оценивая нарушения сна в двух исследуемых группах группах, мы выявили положительную динамику, коррелирующую со снижением частоты СВД в группе пациенток, принимавших циклодинон (табл. 2).
Субъективная оценка качества сна, выраженная в баллах, достоверно повысилась у женщин, принимавших циклодинон, в отличие от пациенток, принимавших мультивитаминный комплекс.
Обсуждение
Аномалии менструального цикла ассоциированы с высоким риском репродуктивных нарушений в будущей жизни [10, 11], поэтому, нормализация ритма менструаций является профилактикой целого ряда заболеваний и залогом сохранения фертильности.
Происхождение функциональных нарушений менструального цикла связывают со стрессовыми воздействиями, получающими физиологический нейроэндокринный ответ, который в условиях повышенной чувствительности к стрессу, или при действии сильного стрессора, или под влиянием других эндогенных и экзогенных факторов, сопровождается выраженными альтерациями нейрогормональной секреции и вторичными репродуктивными нарушениями [12, 13].
Понятие «функциональности» нарушений подчеркивает отсутствие каких-либо повреждений в их основе. Действительно, подавление репродуктивной функции является оптимальным адаптивным ответом при угрозе гомеостазу. Механизмы, лежащие в основе такой супрессии, включают не только прямое воздействие на секрецию гонадолиберина кортиколиберина, но и эффекты кортиколиберин-подобных пептидов, адренокортикотропного гормона, опиоидных пептидов (в том числе, β-эндорфина), кортизола, в дополнение к норадренергическим, γ-аминомасляная кислота (ГАМК)-ергическим, серотонинергическим нейрональным влияниям [11, 14]. В сложные нейрогормональные взаимодействия, реализуемые в процессе адаптации, неизбежно вовлекаются дофаминергические нейроны и пролактин, а изменения секреции пролактина могут стать причиной функциональных нарушений менструального цикла [11].
Патогномоничных клинических признаков нарушения секреции пролактина не существует. Даже галакторея может появляться на фоне нормальных значений уровня пролактина в крови. Но это отражает скорее несовершенство диагностических методов, чем реальную картину клинических и патофизиологических взаимодействий, и требует поиска вероятных клинических маркеров нарушенной секреции пролактина. Именно поэтому мы включили в исследование женщин с галактореей и масталгией, а также с выявленными при трехкратном измерении с недельным интервалом гиперпролактинемией или макропролактинемией, но не ограничивались этими рамками. Единственным критерием, позволившим, на наш взгляд, исключить участие пролактина в формировании расстройств менструального цикла, был его уровень в нижнем диапазоне нормы.
Публикации о положительном опыте применения препаратов витекса священного при менструальной дисфункции появляются регулярно [15, 16]. Результаты проведенного исследования помогли нам точнее очертить терапевтические возможности циклодинона у пациенток с нарушенным менструальным циклом. Малое число наблюдений больных с аменореей не позволяет делать выводы об эффективности лечения у данного контингента. Напротив, в отношении пациенток с олигоменореей нами были получены достоверные результаты, свидетельствующие о положительной динамике продолжительности менструального цикла. Средняя длительность менструального цикла сократилась, в конечном итоге, до величины, укладывающееся в параметры нормы, чего не наблюдалось в группе контроля. Уменьшение длительности межменструальных интервалов происходило в течение первых трех циклов, а начиная с 3-го цикла, на 3-м месяце терапии межменструальный интервал стабилизировался. У больных с олигоменореей циклодинон также был эффективен в отношении кровомазанья, возникающего между или перед менструальными кровотечениями. Способность циклодинона контролировать аномальные кровяные выделения подтверждают исследования, проведенные среди женщин, использующих внутриматочную гормональную контрацепцию [17]. Но при истинных аномальных маточных кровотечениях, в том числе при полименорее, эффективность циклодинона сомнительна.
Основой улучшения характеристик менструального цикла у больных с олигоменореей, применяющих циклодинон, является восстановление овариальной функции. Этот вывод нам позволил сделать сравнительный анализ результатов УЗИ и определения уровня прогестерона в исследуемых группах. У женщин, получавших циклодинон, достоверно чаще в исходе лечения наблюдался овуляторный цикл.
Галакторею, по-видимому, не следует рассматривать как самостоятельный повод для назначения циклодинона и средство оценки его эффективности. Исчезновение выделений из молочных желез в нашем исследовании четко коррелировало с улучшением характеристик менструальной функции, как и сохранение галактореи – с отсутствием улучшений. Продолжительность менструального цикла оказалась более чувствительным и ранним маркером ответа на терапию, и на основании динамики этого показателя мы считаем целесообразным говорить о наличии или отсутствии положительного эффекта терапии через 3–4 месяца от ее начала и прекращать применение препарата в случаях сохранения аменореи в течение 3 месяцев лечения или сохранения/увеличения исходной длительности 3 последовательных межменструальных промежутков.
В отличие от галактореи, масталгия может служить независимым показанием к назначению циклодинона, так как эффект терапии в данном случае очевиден, сравним с эффектом нестероидных противовоспалительных средств [18] и не связан с особенностями менструального цикла. Признаки улучшения могут появляться уже в течение первого месяца терапии, но становятся значимыми, так же как и сокращение продолжительности межменструального промежутка, начиная с 3-го менструального цикла. Дальнейшее применение циклодинона позволяет дополнительно уменьшить выраженность масталгии, что обосновывает целесообразность более длительного, до 6 месяцев, применения препарата. Наши результаты согласуются с данными других исследований, подтверждающих эффективность препаратов витекса священного в терапии масталгии [19].
Циклодинон, имеющий сродство не только к дофаминергическим, но и к опиоидергическим рецепторам, способен оказывать прямое влияние на психическое состояние и вегетативное обеспечение организма [20, 21]. Однако, как показало наше исследование, достоверный положительный эффект циклодинона наблюдается только в более тяжелых случаях – при синдроме вегетативной дистонии. Этот феномен можно объяснить тем, что вегетативная лабильность является менее устойчивым состоянием, и ее динамику сложнее проследить в процессе терапии.
Отмеченные положительные изменения могут быть обусловлены различными механизмами действия циклодинона, но основным из них, несомненно, является нормализация секреции пролактина [21]. По результатам нашего исследования, применение циклодинона в течение 6 месяцев устраняло избыточную секрецию пролактина, транзиторные повышения уровня гормона и макропролактинемию. Ни в одном наблюдении мы не зарегистрировали истинного подавления секреции пролактина с уменьшением уровня гормона близко к нижней границе нормы, то есть эффект циклодинона следует рассматривать как нормализующий аномальную секрецию пролактина функционального происхождения, в отличие от эффекта синтетических дофаминомиметиков, применяемых для подавления избыточной секреции пролактина у больных с синдромом гиперпролактинемии.
Таким образом, циклодинон является эффективным средством лечения функциональных расстройств менструального цикла, предположительно связанных с гипепролактинемией. Достаточным основанием для его назначения, после исключения синдрома гиперпролактинемии, других эндокринопатий и структурных нарушений репродуктивных органов, как причин имеющихся жалоб, следует считать нарушения ритма менструаций по типу олигоменореи, в том числе в сопровождении метроррагий, а также циклическую масталгию, вне зависимости от характера менструального цикла. Однократная оценка уровня пролактина перед началом терапии целесообразна с позиций отсева больных с низким-нормальным уровнем гормона, поскольку в этих случаях вероятность взаимосвязи симптомов с нарушенной секрецией пролактина сомнительна. Эффективность терапии циклодиноном следует оценивать по прошествии 3 менструальных циклов, но не позже чем через 4 месяца от ее начала. Среди оцениваемых критериев должны присутствовать не только клинические характеристики менструального цикла и наличие масталгии, но также и оценка выраженности масталгии по ВАШ. Такая комплексная оценка позволяет объективизировать эффект терапии, улучшить приверженность к ней и избежать полипрагмазии. Отсутствие эффекта от терапии требует пересмотра диагностической и лечебной концепции, при наличии эффекта терапию целесообразно продолжить до 6 месяцев с возможным пролонгированием курса при необходимости.



