Преэклампсия – мультисистемное патологическое состояние, возникающее у 3–5% беременных женщин и являющееся одной из ведущих причин материнской и перинатальной смертности [1]. Как правило, заболевание манифестирует во второй половине беременности с классической триадой симптомов у беременной: гипертензия, протеинурия и периферические отеки [2]. Хотя этиология и патогенез преэклампсии остаются до конца не выясненными, патогенез преэклампсии, согласно современным представлениям, принято считать двухстадийным процессом [3]. Первая стадия заключается в нарушениях процессов плацентации, в основном в результате дезадаптации локального иммунного ответа матери в отношении фетальных тканей, а также нарушения фенотипической трансформации клеток цитотрофобласта при инвазии ими спиральных маточных артерий. Во время эмбрионального развития млекопитающих происходит дифференцировка трофэктодермы в цитотрофобласты, функционирующие в качестве стволовых клеток на ранних стадиях развития плаценты [4] и дифференцирующиеся в клетки ворсин хориона различной специализации, а именно: 1) не пролиферирующие многоядерные синцитиотрофобласты, находящиеся в непосредственном контакте с кровью матери, синтезирующие хорионический гонадотропин, плацентарный лактоген и стероидные гормоны, экспрессирующие HLA-G и предотвращающие развитие реакции отторжения фетальных тканей [5]; 2) вневорсинчатые трофобласты, инвазирующие строму матки и экспрессирующие отцовские антигены, обусловливая воспалительный ответ в децидуальной ткани, вызывая в ней процессы апоптоза и облегчая инвазию трофобласта и ремоделирование спиральных маточных артерий [6]. Инвазирующий трофобласт после смены фенотипа с эпителиального на эндотелиальный встраивается в сосудистую стенку спиральных артерий, обусловливая снижение сосудистого сопротивления и значительное повышение кровотока [7]. Индуцированное трофобластом ремоделирование спиральных артерий является ключевым процессом в развитии беременности, поскольку недостаточная фенотипическая трансформация клеток трофобласта и ограниченная их инвазия, что характерно для преэклампсии, приводит к сниженному кровотоку в системе мать-плод и малому объему плаценты, что не отвечает потребностям растущего плода [8]. В результате развивается ишемия/гипоксия плаценты с последующим нарастанием апоптоза и некроза синцитиотрофобласта и выбросом в кровоток матери микровезикул и клеточных обломков трофобласта [9], а также повреждающих факторов плацентарного происхождения, таких как растворимая fms-подобная тирозинкиназа 1 (sFlt1) провоспалительные цитокины, антитела к рецепторам ангиотензина 1, растворимый эндоглин, фактор некроза опухолей α, интерлейкин 1, фибронектин, фактор свертывания крови VIII [10]. В целом, эти изменения приводят к наступлению второй стадии развития преэклампсии, характеризующейся системной эндотелиальной дисфункцией во многих органах и системах, включая сердечно-сосудистую систему, почки, печень, мозг и др. [11]. В конечном итоге, клиническая манифестация преэклампсии происходит после 20 недели гестации с проявлением симптомов гипертензии и протеинурии на фоне нарушенной клубочковой фильтрации и повышенной проницаемости сосудов в периферических тканях [12].
Применение различных молекулярно-биологических подходов позволило идентифицировать целый спектр дифференциально экспрессированных генов в плаценте беременных с преэклампсией по сравнению с женщинами c физиологическим течением беременности [13, 14], однако генетические и эпигенетические механизмы регуляции экспрессии выявленных генов недостаточно изучены. МикроРНК (мкРНК) представляют собой класс некодирующих малых РНК длиной 21–25 нуклеотидов, осуществляющих эпигенетический контроль уровня экспрессии генов-мишеней в основном на посттранскрипционном уровне, дестабилизируя мРНК и ингибируя трансляцию белка [15]. В целом ряде исследований выявлена роль мкРНК в регуляции развития и функции плаценты. В одной из работ обнаружены изменения уровня экспрессии мкРНК кластеров miR-17-92, C14MC, miR-371-3, C19MC, кластера miR-29, семейства let-7, miR-195 и miR-181c в плаценте в зависимости от сроков гестации [16]. Широкомасштабные исследования экспрессии генов мкРНК в плаценте беременных с физиологическим течением беременности и беременных с преэклампсией [17–19] и преждевременными родами [20] позволило идентифицировать более десятка дифференциально экспрессированных мкРНК в каждом исследовании, причем списки выявленных мкРНК были различными в каждом исследовании с минимальными совпадениями. Причины данных несоответствий, по-видимому, связаны с использованием различных тестовых систем для анализа только определенного набора мкРНК или различиями в топологии исследуемого фрагмента ткани плаценты.
В связи с вышеизложенным, целью настоящего исследования было проведение скрининга мкРНК в ткани плаценты и плазме крови беременных женщин с ранней и поздней преэклампсией с применением метода глубокого секвенирования мкРНК. Данный метод позволяет единовременно проанализировать с высокой точностью и специфичностью все имеющиеся в образце мкРНК, а не ограниченный набор молекул как в случае применения микроматриц, не обладающих высокой специфичностью ввиду перекрестной гибридизации гомологичных мкРНК. Анализ полученных профилей дифференциально экспрессирующихся мкРНК в плаценте и периферической крови беременных женщин, страдающих преэклампсией, по сравнению с практически здоровыми беременными женщинами позволит сопоставить полученные данные с литературными и сделать акцент на тех сигнальных путях, регуляция которых еще не рассматривалась в рамках патогенеза преэклампсии.
Материалы и методы исследования
В исследование были включены 64 беременные женщины в возрасте от 27 до 40 лет, входящих в состав пяти групп (табл. 1): 1) женщины с доношенной физиологической беременностью (n=16, срок беременности 37–40 недель); 2) женщины с физиологически протекающей беременностью без показаний к досрочному родоразрешению, проходящие плановое обследование (n=10, 22–34 нед); 3) беременные женщины с показанием к экстренному кесареву сечению в связи с отсутствием возможности пролонгирования беременности по причиние истмико-цервикальной недостаточности или отслойки плаценты или разрыва плодной оболочки (n=10, 24–34 нед) без клинических проявлений преэклампсии; 4) беременные женщины с умеренной (n=2/16) и тяжелой (n=14/16) ранней преэклампсией (n=16) c манифестацией заболевания на 24–34 нед; 5) беременные женщины с умеренной (n=11/12) и тяжелой (n=1/12) поздней преэклампсией (n=12) c манифестацией заболевания после 34 недели гестации.
Критериями включения была одноплодная беременность, родоразрешение путем кесарева сечения. Критериями исключения было наступление беременности с помощью вспомогательных репродуктивных технологий, многоплодная беременность, отягощенный соматический анамнез беременной женщины, анеуплоидии плода.
Методы исследования включали: общепринятое обследование по наблюдению беременности, ультразвуковое исследование органов малого таза и плода, доплерометрию маточно-плацентарного кровотока, кардиотокографию, измерение артериального давления, определение уровня белка в моче, определение концентрации плацентарного фактора роста (PLGF) и sFlt-1 в сыворотке крови с помощью диагностических тест-систем. Исследование выполняли на основании разрешения Этического комитета ФГБУ НЦАГиП им. В.И. Кулакова МЗ РФ после подписания пациентами информированного согласия.
Патогистологическое исследование последа
Была проведена макро- и микроскопическая оценка последа, а именно: плодных оболочек, пуповины и плаценты с целью подтверждения диагноза, полученного клинико-инструментальными методами. При микроскопической оценке плаценты особое внимание уделялось наличию/отсутствию лимфоидной инфильтрации, структуре ворсинчатого дерева, количеству синцитиальных почек, количеству синцитио-капиллярных мембран, наличию/отсутствию инфарктов.
Выделение РНК из ткани плаценты
Образцы ткани плаценты, взятые для исследования не позднее 10 минут после родоразрешения, представляли собой тканевой срез толщиной 5 мм, проходящий через всю толщу плаценты и охватывающий плодную и материнскую части плаценты целиком от хориальной пластинки до децидуальной оболочки. Взятый образец ткани плаценты промывали в 0,9% NaCl и мгновенно замораживали в жидком азоте для последующего хранения при -80˚С. Суммарную РНК выделяли из 20–40 мг ткани плаценты набором miRNeasy Micro Kit (Qiagen) с последующей дополнительной очисткой суммарной РНК и обогащением фракцией мкРНК набором RNeasyMinElute Cleanup Kit (Qiagen) с использованием автоматической станции QIAcube (Qiagen) в соответствии с протоколами фирмы-производителя. Концентрацию РНК измеряли с использованием флуориметра Qubit 3.0 (Invitrogen?). Выход суммарной РНК из 20–40 мг ткани плаценты составил 8,95±4,95 мкг. Качество образца суммарной РНК проверяли методом капиллярного электрофореза с использованием набора RNA 6000 Nano Kit (Agilent Technologies) в биоанализаторе Agilent Bioanalyzer 2100. В дальнейшее исследование брали образцы суммарной РНК с соотношением молярных концентраций рибосомальных РНК (28S и 18S), равным 1,5–1,8.
Выделение РНК из плазмы периферической крови
Образцы венозной крови беременных женщин собирали в пробирки VACUETTE® с ЭДТА, центрифугировали 20 минут при 300g (4ºС), отбирали плазму, и повторно центрифугировали в течение 10 минут при 14500g. РНК выделяли из 200 мкл плазмы крови набором Serum Plasma (Qiagen) с предварительным добавлением 5,6×108 копий синтетической мкРНК cel-miR-39 (Qiagen) после инкубации плазмы с фенольной смесью Qiazol. cel-miR-39 использовали в качестве внутреннего контроля эффективности выделения РНК, синтеза кДНК и количественной ПЦР в реальном времени.
Глубокое секвенирование мкРНК
кДНК-библиотеки для секвенирования были синтезированы с использованием 1 мкг суммарной РНК плаценты или 250 нг суммарной РНК плазмы крови набором TruSeq™ Small RNA Sample Preparation Kit (Illumina, USA) в соответствии с протоколом фирмы-производителя. Вкратце, малые РНК после лигирования с 3’ и 5’ РНК-адапторами конвертировали в кДНК в реакции обратной транскрипции с последующим проведением ПЦР-амплификации кДНК-библиотеки ткани плаценты (11 циклов) и плазмы крови (15 циклов), и дальнейшей очистки в 6% полиакриламидном геле с извлечением кДНК-фракции длиной 140-160 пар оснований. Элюированные из геля кДНК-библиотеки осаждали смесью ацетат натрия/этанол. Количество и качество кДНК-библиотек определяли в биоанализаторе Agilent 2100 Bioanalyzer (Agilent Technologies, USA), используя чип High Sensitivity DNA chip (Agilent Technologies, USA). Очищенную кДНК-библиотеку секвенировали на платформе HiSeq 2000 (Illumina, USA) в соответствии с рекомендациями фирмы-производителя. Число прочтений индивидуальных молекул мкРНК было получено с использованием прилагаемого к секвенатору программного обеспечения (HiSeq Reporter, Illumina, USA). Прочтения мкРНК были выровнены с последовательностями мкРНК человека, аннотированными в базе данных miRBase (http://www.mirbase.org), используя программу Novoalign (http://www.novocraft.com/products/novoalign/ (параметры: -l 18-h90-rA), позволяющую удалить из кДНК последовательность 3’РНК-адаптора (5’TGGAATTCTCGGGTGCCAAGG) и исключить из рассмотрения последовательности длиной менее 18 нуклеотидов. Нормализацию профиля мкРНК в образце проводили по формуле: (число прочтений индивидуальной мкРНК/суммарное число прочтений всех картированных мкРНК) × 106.
 Обратная транскрипция и количественная ПЦР в реальном времени
Обратная транскрипция и количественная ПЦР в реальном времени
мкРНК (500 нг) из каждого образца конвертировали в кДНК в реакционной смеси (20 мкл), содержащей буфер 1x miScript HiSpec Buffer, нуклеотидную смесь 1х miScript Nucleics Mix, ферментативную смесь miScript Reverse Transcriptase Mix, при 37°C в течение 60 минут с последующей инкубацией при 95°C в течение 5 мин, охлаждением во льду и доведением объема образца деионизованной водой до 200 мкл. Синтезированная кДНК (3 мкл) служила в качестве матрицы в ПЦР в реальном времени с использованием смыслового праймера, специфичного для исследуемой мкРНК: hsa-miR-532-5p (5’-CATGCCTTGAGTGTAGGACCGT), hsa-miR-423-5p (5’-TGAGGGGCAGAGAGCGAGACTTT), hsa-miR-127-3p (5’-CGGATCCGTCTGAGCTTGGCT), hsa-miR-376a-5p (5’-GTAGATTCTCCTTCTATGAGTA), hsa-miR-539-5p (5’-GGAGAAATTATCCTTGGTGTGT), hsa-miR-519a-3p (5’-AAAGTGCATCCTTTTAGAGTG), SNORD68 (5’-ACATTCTCCGGAATCGCTGT-3’) или cel-miR-39 (miScript Primer Assay, Ce_miR-39_1, Qiagen), и набор miScript SYBR Green PCR Kit (Qiagen). Условия реакции ПЦР: 15мин при 95°C с последующим проведением 40 циклов 15 сек при 94°C, 30 сек при 55°C и 30 сек при 70°C в амплификаторе StepOnePlusTM (Applied Biosystems). Сравнение уровня экспрессии мкРНК в контрольном и исследуемом образцах относительно референсных мкРНК (SNORD68 для образцов плаценты, cel-miR-39 для образцов плазмы) проводили с использованием метода 2-ΔΔCT.
Статистическая обработка данных
Анализ значимости различий исследуемых микроРНК в группе преэклампсии и референсной группы соответствующего срока гестации выполнен с использованием двухстороннего теста Вилкоксона–Манна–Уитни. Для анализа взаимосвязи уровня исследуемых микроРНК и вероятностью развития преэклампсии был использован метод логистической регрессии. Для подбора оптимальной предсказательной модели использовался алгоритм пошагового исключения предикторов с оценкой изменения качества на основе функции максимального правдоподобия и количества предикторов. Рассчитанные на основе модели значения вероятности были соотнесены с априорными данными принадлежности к одной из двух групп с учетом оптимального соотношения чувствительности и специфичности.
Анализ выполнен в среде R версии 3.2.4 с использованием пакетов «ggplot2» для визуализации и «caret» для диагностики и подгонки моделей.
Результаты и обсуждение
С целью идентификации ассоциированных с преэклампсией мкРНК было проведено глубокое секвенирование кДНК-библиотек, синтезированных на мкРНК, выделенных из ткани плаценты и плазмы периферической крови беременных женщин, у которых манифестация заболевания произошла на разных сроках беременности (табл. 1), входящих в состав двух основных исследуемых групп беременных: женщины с ранней преэклампсией (манифестация заболевания до 34 недели гестации, 16 человек, Р<34) и женщины с поздней преэклампсией (манифестация заболевания после 34 недели гестации, 12 человек, P>34).
Диагноз «преэклампсия» был поставлен в связи с повышением артериального давления выше 140/90 мм рт. ст., измеренным с четырехчасовым интервалом, и протеинурией свыше 0,3 г/л после 20 недели гестации [21]. Диагноз «тяжелая преэклампсия» был поставлен в связи с наличием одного или нескольких клинических проявлений: 1) систолическое давление выше 160 мм рт. ст. или диастолическое давление выше 110 мм рт. ст., 2) протеинурия выше 5 г/л, 3) очень низкие показатели суточного диуреза (менее 500 мл за 24 часа), 4) респираторные нарушения (отек легких или цианоз), 5) нарушение функции печени, 6) нарушение работы центральной нервной системы (сильная головная боль, зрительные расстройства), 7) боль в эпигастральной области или правом верхнем квадранте, 8) тромбоцитопения и 9) наличие тяжелой задержки внутриутробного развития [21]. Диагноз «преэклампсия» был подтвержден в ходе микроскопического исследования выявлением увеличенного количества синциальных почек (выраженный признак Тенни–Паркера), преимущественно разветвленного типа ангиогенеза терминальных ворсин, наличия афункциональных зон ворсинчатого дерева со спавшимися капиллярами ворсин, очагового атероза сосудов стволовых ворсин и десквамации синцитиотрофобласта ворсин. Кроме того, у беременных женщин с преэклампсией было обнаружено повышение уровня sFlt-1 и снижение уровня PlGF в сыворотке крови (табл. 1), что согласуется с литературными данными об их роли в патогенезе преэклампсии и прогнозировании риска возникновения данного заболевания [22]. Практически здоровыми с физиологически протекающей беременностью считали женщин без медицинских, акушерских или хирургических осложнений на момент исследования, которые впоследствии родили доношенного ребенка весом более 2500 г после 37 недели гестации (16 человек, N>34; 10 человек, N<34). В группу сравнения для исследования ранней преэклампсии входили беременные женщины без клинических проявлений преэклампсии, но которым было показано экстренное кесарево сечение в связи с преждевременной родовой деятельностью до 34 недели гестации (истмико-цервикальная недостаточность, отслойка плаценты, разрыв плодных оболочек, 10 человек, N<34).
В результате проведения метода глубокого секвенирования были сопоставлены профили экспрессии мкРНК плаценты и плазмы периферической крови беременных с преэклампсией и женщин с неосложненной беременностью и идентифицированы дифференциально экспрессированные мкРНК с числом прочтения не менее 10. В группе беременных с ранней преэклампсией выявлено снижение экспрессии 87 мкРНК в плаценте и 13 мкРНК в плазме крови. При этом повышенный уровень экспрессии обнаружен у 237 мкРНК в плаценте и 128 мкРНК в плазме крови.
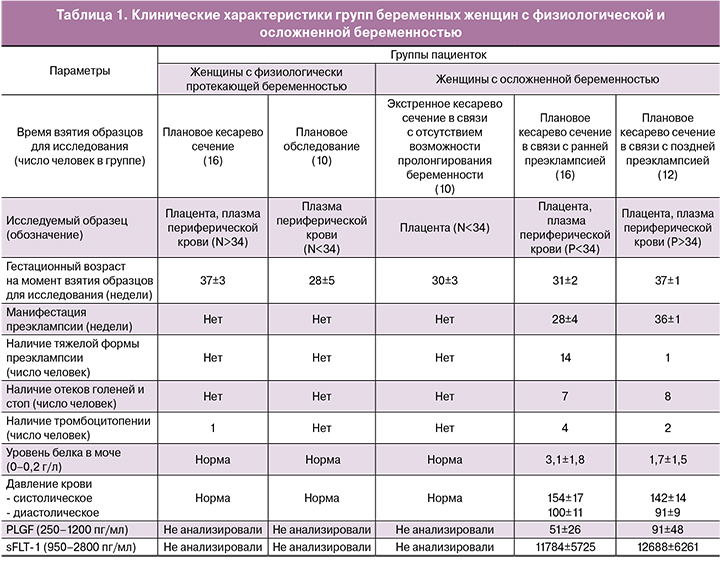
В группе беременных с поздней преэклампсией идентифицировано 152 мкРНК в плаценте и 12 мкРНК в плазме крови с пониженной экспрессией, а также 153 и 59 мкРНК с повышенным уровнем экспрессии в плаценте и плазме, соответственно. Для выявления общих дифференциально экспрессирующихся мкРНК в плаценте и плазме крови беременных с ранней и поздней преэклампсией были построены диаграммы Венна (рис. 1).
Однонаправленные изменения экспрессии мкРНК были обнаружены у беременных с ранней и поздней преэклампсией в плаценте (37 мкРНК – сниженный уровень, 83 мкРНК – повышенный уровень) и в плазме крови (6 мкРНК – сниженный уровень, 49 мкРНК – повышенный уровень). Среди них, сниженный уровень экспрессии в плаценте и плазме крови имела hsa-let-7e-5p, повышенный уровень экспрессии в плаценте и плазме крови имели 6 мкРНК (hsa-miR-1246, -1307-5p, -183-5p, -375, -19a-3p, -125b-5p), снижение уровня экспрессии в плаценте и повышение уровня экспрессии в плазме крови было характерно для 5 мкРНК (hsa-miR-532-5p, -130b-3p, -1285-3p, -143-3p, hsa-let-7c-5p).
Особого внимания заслуживают выявленные нами дифференциально экспрессированные мкРНК, специфичные для трофобласта и кодируемые ассоциированными с беременностью кластерами генов 14 и 19 хромосом. Согласно литературным данным в специфичном для плаценты профиле экспрессии мкРНК доминирующими являются мкРНК, экспрессирующиеся в клетках трофобласта [23] и кодирующиеся тремя кластерами генов 14-й хромосомы (C14MC) и двумя кластерами генов 19-й хромосомы (C19MC и miR-371-3) [24]. Эти кластеры локализуются внутри импринтинговых генов, регулирующих эмбриональное развитие и клеточную дифференцировку, экспрессируются исключительно либо на материнской хромосоме (С14МС), либо на отцовской хромосоме (С19МС), и их экспрессия ассоциирована со статусом метилирования дистальных CpG-богатых областей. Уровни экспрессии мкРНК этих кластеров изменяются на протяжении беременности, а именно: мкРНК C14MC высоко экспрессируется в клетках трофобласта первого триместра беременности с последующим снижением экспрессии в третьем триместре, в то время как мкРНК C19MC экспрессируется на низком уровне во время первого триместра беременности, но высоко экспрессируется к концу беременности [23]. Было обнаружено, что miR-517a-3p, miR-519a-3p и miR-520c-3p также в значительной степени представлены в мезенхимальных стромальных клетках плаценты [25], указывая на то, что их локализация и функция в плаценте не ограничиваются трофобластом. Кроме того, некоторые из специфичных для плаценты мкРНК были обнаружены в крови матери на протяжении беременности со значительным снижением концентрации после родов, включая miR-515-3p, miR-516-5p, miR-517a, miR-517c, miR-518b, miR-520a*, miR-520h, miR-525, miR-526a и miR-526b [26, 27]. Таким образом, специфичные для плаценты и циркулирующие в кровотоке мкРНК могут быть использованы в диагностике различных осложнений беременности, включая преэклампсию.
В настоящей работе обнаружено снижение уровня экспрессии 6 мкРНК из 72 идентифицированных в результате секвенирования мкРНК кластера С14МС (hsa-miR-323b-3p, -369-5p, -411-3p, -539-5p, -494-3p, -376a-5p) и повышение уровня экспрессии 7 мкРНК из 50 выявленных секвенированием мкРНК кластеров С19МС и miR-371-3 (hsa-miR-371a-3p, -371a-5p,-372-3p, -373-3p, -519a-3p, -517c-3p, -519a-5p) в плаценте беременных женщин, как при поздней, так и при ранней преэклампсии. Кроме того, выявлено снижение уровня экспрессии hsa-miR-512-3p кластера С19МС и повышение уровня экспрессии hsa-miR-127-3p и hsa-miR-409-3p кластера С14МС в плазме беременных с ранней и поздней преэклампсией.
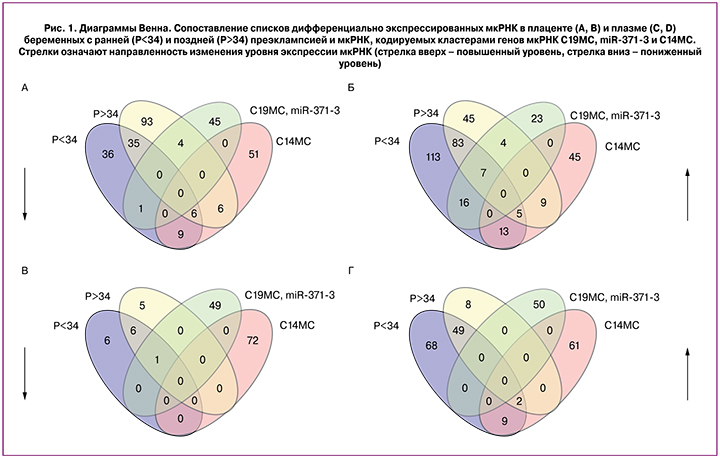
С целью верификации данных глубокого секвенирования мкРНК, проведенного на единичных образцах исследуемых групп, был применен метод количественной ПЦР в реальном времени. Были проанализированы все собранные образцы исследуемых групп (n=64) для оценки уровня экспрессии 6 мкРНК (hsa-miR-532-5p, hsa-miR-423-5p, hsa-miR-127-3p, hsa-miR-376a-5p, hsa-miR-539-5p, hsa-miR-519a-3p), выбранных по результатам секвенирования в связи с их дифференциальной экспрессией в плаценте и/или плазме крови беременных с преэклампсией и одинаковой направленностью изменений экспрессии при ранней и поздней преэклампсии.
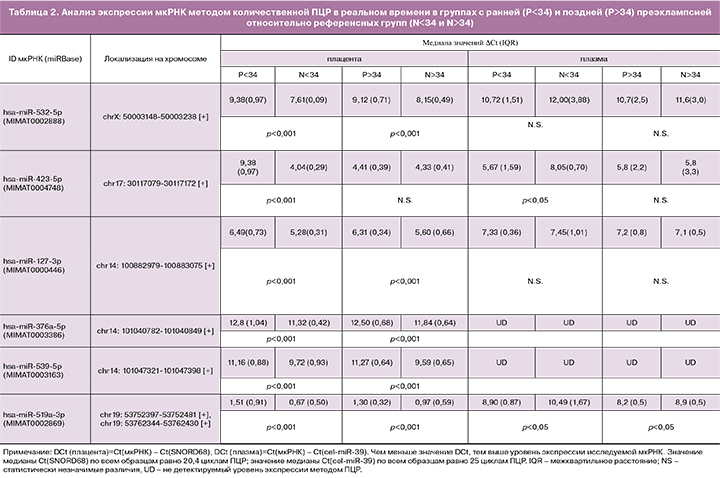
При оценке тождественности референсных групп (N<34 и N>34) наблюдали значимые различия (p<0,05) образцов плазмы крови и плаценты по экспрессии ряда мкРНК (в образцах крови: miR-519a-3p, -423-5p; в образцах плаценты: miR-127-3p, -532-5p, -376a-5p), применяя тест Вилкоксона. В связи с этим, сопоставление групп беременных с ранней и поздней преэклампсией осуществляли с референсной группой соответствующего срока гестации. Результаты данного сравнительного анализа представлены в табл. 2 и на рис. 2.
Выявлено значимое снижение уровня экспрессии hsa-miR-532-5p, -423-5p, -127-3p, -376a-5p, -539-5p, -519a-3p в плаценте и повышение уровня экспрессии hsa-miR-423-5p и -519a-3p в плазме крови беременных с ранней преэклампсией. Та же направленность значимых изменений уровня экспрессии, но менее выраженная, была выявлена для вышеперечисленных мкРНК, за исключением miR-423-5p, в плаценте и плазме крови беременных женщин с поздней преэклампсией.
Для оценки влияния мкРНК на регуляторные сигнальные пути был проведен анализ базы данных DIANA miRPath v.2.0 (http://www.microrna.gr/miRPathv2). Установлено, что hsa-miR-532-5p, -423-5p, -127-3p, -376a-5p, -539-5p, -519a-3p являются потенциальными регуляторами сигнальных путей, участвующих в процессинге и презентации антигена (hsa04612 – идентификационный номер KEGG-сигнального пути), реакции «трансплантат против хозяина» (hsa05332) или отторжении аллотрансплантата (hsa05330), развитии аутоиммунных заболеваний (hsa05320, hsa05323, hsa05322), каскадов реакций активации комплемента и коагуляции крови (hsa04610), регулируемой альдостероном реабсорбции натрия (hsa04960), ренин-ангиотензиновой системе (hsa04614), прогестерон-опосредованном созревании ооцита (hsa04914), внутриклеточном транспорте кальция и кальций-зависимых реакциях (hsa04020), фокальной адгезии (hsa04510) и регуляции актинового цитоскелета (hsa04810), а также являются регуляторами р53-опосредованного сигнального пути (hsa04115), контролирующего клеточный цикл, клеточный апоптоз и репарацию ДНК, что в целом укладывается в общепринятое представление о патогенезе преэклампсии.
По литературным данным выявлена роль miR-532 в регуляции генов, участвующих в децидуализации и сохранении беременности на ранних сроках гестации [28], а также процессов тромбообразования [29]. miR-423-5p участвует в ингибировании транскрипции рецептора прогестерона путем взаимодействия с некодирующей РНК, комплементарной промотору гена рецептора прогестерона, и доставки хроматин-модифицирующих ферментов в комплексе с Ago2 к промотору гена [30], а также в посттранскрипционной регуляции экспрессии генов CYP19A1 и PCNA, влияя на фолликулогенез и стероидогенез в яичниках [31]. miR-127-3p является основным посттранскрипционным регулятором импринтингового ретротранспозон-подобного 1 гена (Rtl1), влияющего на плацентацию у млекопитающих [32]. Выявлена роль miR-127 и miR-376a в посттранскрипционной регуляции плюрипотентности и дифференцировки поздней бластоцисты на стадии хэтчинга [33], miR-376a – в формировании примордиального фолликула путем изменения уровня экспрессии PCNA [34], а также в регуляции пролиферации, апоптоза, миграции и инвазии клеток метастазирующего рака простаты [35], miR-539-5p – во фрагментации митохондрий и апоптозе клеток путем посттранскрипционной регуляции экспрессии гена субъединицы PHB2 прохибитина, являющегося ключевым регулятором многих сигнальных путей, контролирующих клеточную выживаемость, метаболизм и воспаление [36].
Важно отметить, что достоверные изменения уровней экспрессии hsa-miR-532-5p, -423-5p, -127-3p, -376a-5p, -539-5p в плаценте и/или плазме крови беременных, страдающих преэклампсией, нами были выявлены впервые, и их функциональную значимость в рамках патогенеза преэклампсии предстоит выяснить, что является целью наших дальнейших исследований. Полученные нами данные ПЦР по уровню экспрессии miR-519a-3p согласуются с литературными данными [37], где было выявлено достоверное снижение уровня экспрессии miR-519a-3p в плаценте беременных с преэклампсией методом TaqMan-ПЦР.
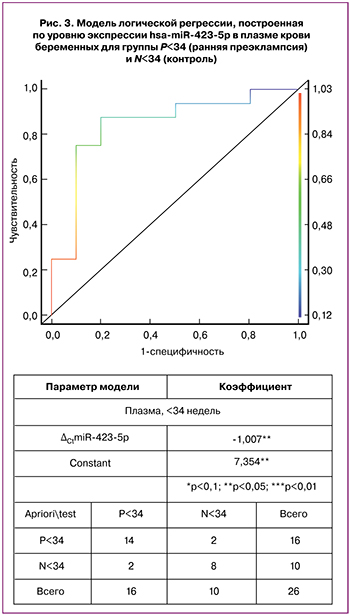
Для определения предсказательной способности сочетаний уровня экспрессии исследуемых мкРНК в отношении развития преэклампсии была построена модель логистической регрессии. Было выявлено увеличение вероятности развития ранней преэклампсии с увеличением уровня экспрессии miR-423-5p в плазме крови. Границей дихотомии группы с ранней преэклампсией (P<34) и референсной группы (N<34) принято значение 0.5 вероятности развития преэклампсии согласно модели. Чувствительность теста составляет 88% [83–90%], специфичность – 80% [73–84%], точность – 85% [65–96%] (рис. 3). Биномиальный доверительный интервал (95% CI) для представленных значений был рассчитан по методу Клоппера–Пирсона.
Заключение
Проведение анализа уровня экспрессии miR-423-5p в плазме крови беременных женщин может служить основой для разработки скринингового теста по выявлению преэклампсии до начала манифестации клинических признаков заболевания для своевременного принятия мер по предотвращению развития осложнений, ассоциированных с данным заболеванием. Для повышения чувствительности, специфичности и точности используемого теста необходимо провести дальнейший анализ уровня экспрессии miR-423-5p на большей выборке беременных женщин с преэклампсией и без клинических признаков данного заболевания с формированием большего количества групп, различающихся по срокам гестации на 2–3 недели.



