Гипопаратиреоз – эндокринное заболевание, характеризующееся низким уровнем паратиреоидного гормона (ПТГ) и нарушением минерального обмена. Изменения фосфорно-кальциевого метаболизма во время беременности у пациенток с хроническим гипопаратиреозом требуют проведения регулярной оценки лабораторных показателей и своевременной коррекции доз препаратов с целью профилактики гипо- и гиперкальциемических состояний [1].
Физиологические аспекты регуляции минерального обмена во время беременности
К одному из основных компенсаторных механизмов, обеспечивающих плод достаточным количеством кальция во время беременности, относится усиление его абсорбции в кишечнике матери. В период лактации адекватная концентрация кальция в грудном молоке достигается в основном за счет усиления резорбтивных процессов в костной ткани. Эти изменения связаны с увеличением продукции таких ключевых гормонов, как кальцитриол и ПТГ-подобный пептид (ПТГпП) [2].
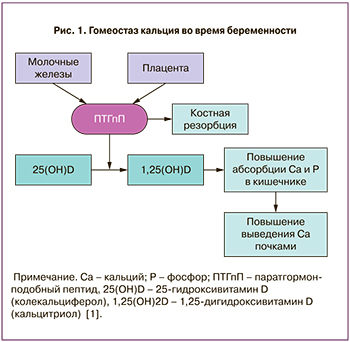 Увеличение синтеза кальцитриола наблюдается с I триместра, и к концу беременности его уровень составляет до 2–3 норм. Регуляция метаболизма витамина D у беременной женщины в основном зависит от активности 1α-гидроксилазы почек, находящейся под контролем эстрогенов, пролактина и человеческого плацентарного лактогена (рис. 1). При этом уровень 25(ОН) витамина D остается стабильным, несмотря на усиление его конверсии в активную форму [2]. Во многих тканях организма, включая молочные железы, децидуальную оболочку, плаценту и др., увеличивается синтез ПТГпП [3, 4]. Уровень ПТГпП возрастает с 3-й по 13-ю неделю гестации и более чем втрое превышает показатель до беременности. Именно в эти периоды ПТГпП действует как эндокринный фактор, регулирующий минеральный и костный гомеостаз независимо от ПТГ. ПТГпП, так же как и ПТГ, способен стимулировать резорбцию костной ткани, реабсорбцию кальция в почках, что в комплексе обеспечивает насыщение грудного молока необходимым для новорожденного количеством кальция [5, 6].
Увеличение синтеза кальцитриола наблюдается с I триместра, и к концу беременности его уровень составляет до 2–3 норм. Регуляция метаболизма витамина D у беременной женщины в основном зависит от активности 1α-гидроксилазы почек, находящейся под контролем эстрогенов, пролактина и человеческого плацентарного лактогена (рис. 1). При этом уровень 25(ОН) витамина D остается стабильным, несмотря на усиление его конверсии в активную форму [2]. Во многих тканях организма, включая молочные железы, децидуальную оболочку, плаценту и др., увеличивается синтез ПТГпП [3, 4]. Уровень ПТГпП возрастает с 3-й по 13-ю неделю гестации и более чем втрое превышает показатель до беременности. Именно в эти периоды ПТГпП действует как эндокринный фактор, регулирующий минеральный и костный гомеостаз независимо от ПТГ. ПТГпП, так же как и ПТГ, способен стимулировать резорбцию костной ткани, реабсорбцию кальция в почках, что в комплексе обеспечивает насыщение грудного молока необходимым для новорожденного количеством кальция [5, 6].
Продукция ПТГ околощитовидными железами держится в низко-нормальном диапазоне и может быть даже ниже популяционных референсных показателей в I триместре беременности [2], что связано с гестационным повышением продукции ПТГпП и кальцитриола, которое фиксируется с 3-й недели беременности. Таким образом, ПТГ как регулятор фосфорно-кальциевого обмена теряет свою доминирующую роль в этот период, и только к концу III триместра его продукция восстанавливается.
Кальцитонин – гормон-антагонист ПТГ, продуцируемый С-клетками щитовидной железы, а в периоды беременности и лактации – молочными железами и плацентой [7]. Повышение уровня кальцитонина во время беременности и лактации отмечено также у пациенток, ранее перенесших тотальную тиреоидэктомию [8]. Увеличение синтеза этого гормона во время беременности реализуется за счет эффектов эстрогенов (эстрадиола, эстрона и эстриола) и направлено на подавление активной деминерализации скелета матери.
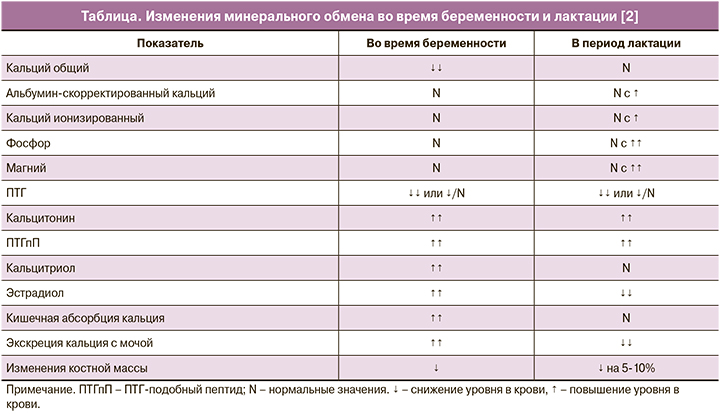
Во время беременности и лактации за счет увеличения объема циркулирующей крови и гемодилюции снижается уровень общего кальция сыворотки крови, в то время как уровни альбумин-скорректированного и ионизированного кальция остаются неизменными (таблица). Уровень кальция крови плода, как правило, оказывается несколько выше данного показателя у матери [9, 10].
Особенности ведения беременности у пациенток с гипопаратиреозом
В Европейских клинических рекомендациях по ведению пациентов с хроническим гипопаратиреозом от 2015 г. [11] указывается на отсутствие различий в тактике лечения гипопаратиреоза на фоне беременности и в общей популяции и рекомендуется использование стандартных доз активных метаболитов/аналогов витамина D (кальцитриол, альфакальцидол, 0,5–2,0 мкг/сутки) и препаратов кальция (1000–1500 мг). Начальная доза кальцитриола/альфакальцидола составляет, как правило, 0,25 мкг 1–2 раза в сутки и далее еженедельно увеличивается до достижения низко-нормального уровня сывороточного кальция. По данным Европейских клинических рекомендаций, несмотря на физиологическое увеличение продукции кальцитриола и ПТГпП, медикаментозная терапия может оставаться неизменной в течение всей беременности. Однако в ряде случаев с 20-й недели беременности необходимо увеличение доз активных метаболитов/аналогов витамина D и препаратов кальция в связи с возрастающей потребностью плода в данном микроэлементе и для предотвращения симптомов гипокальциемии у матери [11].
Во время лактации повышение секреции ПТГпП, как правило, требует снижения доз активных метаболитов/аналогов витамина D и препаратов кальция с целью профилактики развития гиперкальциемических состояний. Однако данная рекомендация также должна рассматриваться применительно к конкретной клинической ситуации и имеет низкую степень доказательности. После окончания лактации потребность в препаратах возвращается к прежнему уровню до беременности. Во время лактации мониторинг показателей фосфорно-кальциевого обмена должен проводиться каждые 4–6 недель, с обязательным контролем в период отнятия ребенка от груди [11].
В 2018 г. впервые опубликовано отдельное руководство, посвященное особенностям терапии гипопаратиреоза на фоне беременности. Сформированные рекомендации носят слабый уровень доказательности, так как в большей степени основаны на описании серии клинических наблюдений. Тем не менее они являются полезным обобщением имеющегося мирового опыта по ведению данной группы пациентов [1].
Клинические рекомендации включают в себя следующие пункты:
- рекомендуется поддержание уровней ионизированного и альбумин-скорректированного кальция крови в пределах нижне-нормального диапазона (для альбумин-скорректированного кальция в пределах 2,1–2,3 ммоль/л, для ионизированного кальция – в пределах 1,1–1,25 ммоль/л) во избежание неблагоприятного воздействия на развитие околощитовидных желез плода. Для расчета уровня альбумин-скорректированного кальция применяют формулу: общий кальций плазмы (с поправкой) (ммоль/л) = измеренный уровень кальция плазмы (ммоль/л) + 0,02 × (40 – измеренный уровень альбумина плазмы (г/л)) (очень слабая рекомендация);
- в период гестации рекомендуется проводить мониторинг показателей фосфорно-кальциевого обмена с частотой 1 раз в 3–4 недели для профилактики гипо- и гиперкальциемии (очень слабая рекомендация);
- в случае изменения дозировок препаратов кальция и активных метаболитов витамина D рекомендуется более частый контроль, в среднем 1 раз в 7–14 дней, до достижения целевых показателей кальциемии. Рекомендуемый интервал для оценки проводимой коррекции терапии основан на том, что период полувыведения кальцитриола составляет около 4–6 часов, а устойчивая концентрация кальция достигается за период, эквивалентный 5 периодам полураспада кальцитриола (очень слабая рекомендация);
- рекомендуется поддерживать уровни фосфора, магния, 25(ОН) витамина D и кальция в суточной моче в пределах референсного диапазона (очень слабая рекомендация);
- рекомендуется прекратить лечение тиазидными диуретиками на период беременности и лактации (средняя рекомендация) [12];
- рекомендуется прекратить лечение рекомбинантным ПТГ (ПТГ1-84 или ПТГ1-34) на период беременности и лактации (слабая рекомендация) [13];
- рекомендуется обучение пациенток, направленное на повышение информированности о симптоматике гипо- и гиперкальциемии (очень слабая рекомендация).
Для разбора особенностей динамического наблюдения и коррекции терапии хронического послеоперационного гипопаратиреоза во время беременности и лактации представляется описание клинического наблюдения.
Клиническое наблюдение
Пациентка Я., 29 лет, с впервые диагностированным диффузным токсическим зобом тяжелой степени в 2010 г. находилась на консервативном лечении тиреостатиками. В 2013 г. в связи с рецидивирующим течением диффузного токсического зоба произведена тотальная тиреоидэктомия, в раннем послеоперационном периоде развились симптомы гипокальциемии – парестезии, судороги верхних и нижних конечностей, околоротовой области. При физикальном осмотре отмечались положительные симптомы Хвостека и Труссо. Инициирована терапия препаратами кальция (2500 мг/сутки) и активными метаболитами витамина D (альфакальцидол 1 мкг/сутки), к которым в дальнейшем присоединен препарат нативной формы витамина D (колекальциферол 12 500 МЕ/неделю). Эпизоды парестезий и судорог в руках и ногах, однако, сохранялись. На фоне заместительной терапии левотироксином натрия (125 мкг/сутки) отмечалась компенсация послеоперационного гипотиреоза.
Через 6 месяцев после операции потребность в препаратах кальция и витамина D осталась на том же уровне, в связи с чем диагностирован хронический послеоперационный гипопаратиреоз.
В 2015 г. пациентка впервые была госпитализирована в ФГБУ «НМИЦ эндокринологии» Минздрава России с жалобами на ощущения «ползания мурашек» на руках и ногах, онемение губ, периодические судороги верхних и нижних конечностей, более выраженные во второй половине дня. При обследовании подтвержден гипопаратиреоз (ПТГ 7,0 пг/мл (15–65)), гипокальциемия (кальций общий 2,0 ммоль/л (2,1–2,55), кальций ионизированный 0,95 ммоль/л (1,03–1,29)) и гиперфосфатемия (фосфор 1,9 ммоль/л (0,74–1,25)). Суточная экскреция кальция сохранялась в пределах референсных значений (3,34–4,47 ммоль/сутки). Ввиду отсутствия клинико-лабораторной компенсации заболевания проведена коррекция терапии – увеличена доза альфакальцидола до 2 мкг в сутки, терапия препаратами кальция продолжена в прежних дозах (2500 мг/сутки). На фоне постоянного приема препаратов нативной формы витамина D (колекальциферол 12500 МЕ/неделю) был достигнут целевой уровень 25(ОН)D – 49 нг/мл (30–100)). На момент выписки из стационара самочувствие пациентки улучшилось, эпизоды судорог и парестезий не беспокоили. Прием левотироксина натрия продолжался в прежней дозировке (ТТГ 1,3 мМЕ/л (0,25–3,5)).
При динамическом контроле в течение последующего года, на фоне терапии – альфакальцидол 1,75 мкг/сутки, карбонат кальция 3000 мг/сутки, колекальциферол 12500 МЕ/неделю – самочувствие оставалось стабильным, симптомов гипокальциемии не отмечалось, лабораторные показатели в пределах целевых значений (кальций общий 2,05–2,29 ммоль/л, кальций ионизированный 1,09–1,15 ммоль/л, кальций в суточной моче 5,6–6,2 ммоль/сутки, фосфор 1,42–1,52 ммоль/л, 25(ОН) витамин D 74,3 нг/мл).
В марте 2017 г. наступила самопроизвольная беременность. По рекомендациям эндокринолога увеличена доза левотироксина натрия до 150 мкг/сутки. В связи с тенденцией к гиперкальциемии, по данным лабораторного контроля, доза альфакальцидола уменьшена до 0,5 мкг в сутки, доза колекальциферола снижена до 1500 МЕ/сутки, продолжен прием препаратов кальция в прежнем режиме.
В течение всей беременности пациентка амбулаторно наблюдалась в ФГБУ «НМИЦ эндокринологии» Минздрава России. В связи с появлением симптомов гипокальциемии (эпизоды парестезий до нескольких раз в день), несмотря на целевой уровень ионизированного кальция (1,14 ммоль/л) на сроке 13–14 недель доза альфакальцидола увеличена до 0,75 мкг в сутки (рис. 2). В дальнейшем прием активных метаболитов витамина D оставался прежним до момента родов, так же как и препаратов кальция и колекальциферола. На сроке 24–25 недель уровень ионизированного кальция составил 1,12 ммоль/л; в III триместре (31 неделя беременности) – 1,16 ммоль/л. Определялся оптимальный уровень 25(ОН) витамина D – 47,1 нг/мл. Таким образом, показатели кальциемии сохранялись в пределах низко-нормальных значений на протяжении всей беременности, которая завершилась родами в срок (39 недель и 6 дней). Признаков патологии фосфорно-кальциевого обмена у ребенка не выявлено.
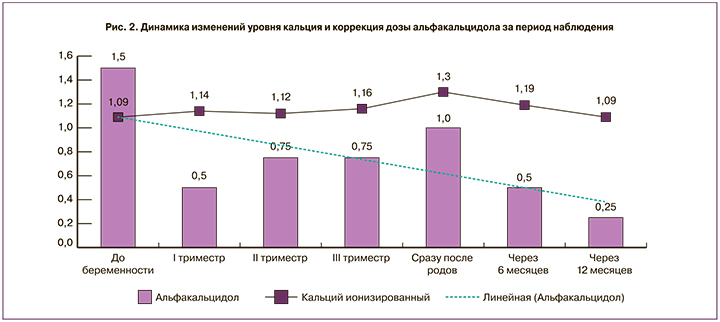
В послеродовом периоде симптомов гипокальциемии не наблюдалось. Несмотря на данные литературы о снижении потребности в препаратах активных метаболитов витамина D во время лактации, в данном клиническом случае первоначально потребовалось увеличение дозы альфакальцидола до 1 мкг в сутки в связи с тенденцией к гипокальциемии по данным лабораторного контроля.
В дальнейшем, наоборот, отмечалось превышение целевого диапазона кальциемии, в связи с чем через 6 месяцев после родов доза препаратов кальция была снижена до 2000 мг/сутки, альфакальцидола – до 0,5 мкг, еще через 6 месяцев – доза альфакальцидола уменьшена до 0,25 мкг, дозы препаратов кальция и колекальциферола – прежние (рис. 2). При динамическом наблюдении в течение 1 года после родоразрешения самочувствие пациентки остается удовлетворительным, симптомов гипокальциемии не наблюдается, уровень ионизированного кальция сохраняется в целевом диапазоне (1,12–1,3–1,22 ммоль/л). В настоящее время продолжается период лактации, осуществляется регулярный динамический контроль за состоянием кальций-фосфорного обмена.
Заключение
Представленный клинический случай демонстрирует необходимость регулярного динамического наблюдения молодых женщин с хроническим гипопаратиреозом во время беременности и лактации. Течение заболевания в данные периоды крайне вариабельно и может проявляться как улучшением общего самочувствия и уменьшением потребности в стандартной терапии, так и утяжелением состояния с необходимостью назначения высоких доз препаратов кальция и активного метаболита витамина D для предотвращения гипокальциемии и уменьшения рисков прерывания беременности.
Принимая во внимание, что гипо- и гиперкальциемические состояния представляют серьезную опасность для матери и плода, поддержание целевых показателей минерального обмена является строго обязательным для предотвращения ассоциированных осложнений. Знание основных закономерностей изменения кальций-фосфорного метаболизма позволяет спрогнозировать и проводить своевременную коррекцию терапии.



