Увеличение продолжительности жизни населения повышает актуальность усовершенствования методов диагностики и лечения заболеваний, ассоциированных с возрастом. В связи с этим, большое внимание уделяется этиологическим и патогенетическим аспектам симптомов гиперактивного мочевого пузыря (ГМП) и генитоуринарного менопаузального синдрома [1]. Согласно новой терминологии, принятой в 2014 г. Международным обществом по изучению женского сексуального здоровья и Североамериканским обществом по менопаузе, генитоуринарный менопаузальный синдром определяется как совокупность симптомов и признаков, связанных с уменьшением эстрогенов и других половых стероидов, приводящих к изменению половых губ, клитора, преддверия, влагалища, уретры и мочевого пузыря [2].
Цель исследования: выявить распространенность, структуру, факторы риска развития симптомов ГМП у женщин в постменопаузе и оптимизировать диагностические критерии.
Материал и методы исследования
В научно-поликлинических отделениях ФГБУ Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова и ГБУ Московский областной научно-исследовательский институт акушерства и гинекологии проведено исследование по оптимизации методов диагностики и лечения ГМП у женщин с генитоуринарными расстройствами в климактерии. В исследование были включены 503 женщины в возрасте 45–70 лет (средний возраст 56,5±7,4 года) и длительностью постменопаузы более 1 года (в среднем 6,3±7,4 года). Для выявления распространенности симптомов нарушения мочеиспускания и оценки факторов риска проведен опрос по разработанной анкете. Вид нарушений мочеиспускания оценивали по следующим критериям (согласно рекомендациям ICS): 1) стрессовое недержание мочи (НМ) (легкая, умеренная, тяжелая степень) – НМ при кашле, чихании, физической нагрузке различной интенсивности; 2) симптомы ГМП – повышение частоты мочеиспускания в дневное и ночное время; наличие императивного позыва и ургентного НМ [3].
Детальное клинико-лабораторное обследование проводилось у 70 пациенток, предъявляющих жалобы на частые дневные и ночные мочеиспускания, повелительный позыв с неудержанием мочи или без него. Помимо стандартных методов исследования, заполнения дневников мочеиспускания, осмотра на гинекологическом кресле всем пациенткам исходно проводилось комплексное уродинамическое исследование (КУДИ), на основании которого, с учетом жалоб, устанавливался диагноз ГМП. Специальные методы исследования включали оценку индекса вагинального здоровья, ультразвуковую оценку толщины стенки мочевого пузыря и проводились всем пациенткам исходно, через 3 и 6 месяцев наблюдения.
Результаты исследования
Результаты анкетирования женщин показали, что нарушение мочеиспускания имеется у 211 (41,9%) обследованных в возрасте от 45 до 70 лет (средний возраст 60,1±5,3 лет). Повышение риска возникновения симптомов отмечено у женщин в возрасте 60–64 лет, RR=1,22 (95% д. и. 1,02–1,5; р<0,05), что коррелирует с продолжительностью постменопаузы и подтверждает вклад прогрессирующего дефицита эстрогенов в генез симптомокомплекса.
Средняя продолжительность постменопаузы в группе всех опрошенных женщин составила 6,3±7,4 лет, в группе пациенток с нарушениями мочеиспускания этот показатель составил 12,1±5,6 лет. Расчет относительного риска показал статистически значимую зависимость длительности постменопаузы более 6 лет и симптомов нарушения мочеиспускания RR=4,5 (95% д.и. 1,7–10,0; р<0,05).
Средний вес женщин с нарушениями мочеиспускания составил 68,4±9,6 кг; средний рост – 162,5±4,9 см. Средние значения индекса массы тела (ИМТ) составили 25,9±4,4 кг/м2. Оценка риска нарушений мочеиспускания показала его повышение в группе женщин с величиной ИМТ более 25 кг/м2, RR=1,79 (95% д. и. 1,06–2,30; р<0,05). Вероятно, закономерное развитие метаболических нарушений в период пери- и постменопаузы негативно влияет и на возникновение урогенитальных расстройств. Взаимосвязь симптомов нарушений мочеиспускания и массы тела, по видимому, обусловлена неблагоприятным действием повышенного внутрибрюшного давления на нижние отделы мочевого тракта, особенно при наличии атрофических изменений на фоне прогрессирующего дефицита половых стероидов.

Показано, что пациентки с нарушениями мочеиспускания чаще имели роды через естественные родовые пути (р<0,01), по сравнению с группой контроля. Статистически значимого различия по количеству операций кесарева сечения выявлено не было (р=0,06). Установлен риск развития симптомов заболевания в группе женщин, имеющих роды через естественные родовые пути в анамнезе, RR=1,80 (95% д. и. 1,4–2,31, р<0,05). Интересно, что показатель RR увеличивался с повышением числа родов через естественные родовые пути от 1,64 до 1,95. Взаимосвязь нарушений мочеиспускания у женщин в постменопаузе и наличия самопроизвольных родов в анамнезе можно объяснить негативным воздействием возрастных изменений в структуре урогенитального тракта на возможные ишемические и травматические последствия родоразрешения.
Оценка анамнеза пациенток с нарушениями мочеиспускания выявила наличие в прошлом или в настоящее время симптомов вульво-вагинальной атрофии (сухость, зуд во влагалище, дискомфорт при половых контактах) у 165 (78,2%) женщин, средний возраст составил 62,3±4,7 года, средняя продолжительность постменопаузы 11,0±5,1 года. С помощью корреляционного анализа выявлена прямая сильная зависимость между наличием симптомов вульво-вагинальной атрофии и всеми видами нарушений мочеиспускания у женщин в постменопаузе (r=1,0; р<0,05).
Среди опрошенных женщин с нарушениями мочеиспускания у 24 (11,4%) отмечались данные симптомы до наступления менопаузы, при сравнении с контрольной группой этот показатель был достоверно выше (р<0,001). Установлен статистически значимый риск симптомов нарушений мочеиспускания у женщин в постменопаузе, отмечающих наличие заболевания до наступления менопаузы, RR=1,05 (95% д. и. 0,83–1,32; р<0,02). Все женщины данной группы предъявляли жалобы на усугубление симптомов в настоящее время. Корреляционный анализ выявил прямую умеренную зависимость между наличием симптомов нарушений мочеиспускания до наступления менопаузы и таковыми в постменопаузе (r=0,71; р<0,05).
Таким образом, различные виды нарушений мочеиспускания выявляются практически у каждой второй женщины в постменопаузе (41,9%). Доминируют симптомы ГМП (39,3%) и смешанное НМ (35,5%), изолированная форма стрессового НМ встречается несколько реже (25,2%).
В структуре симптомов ГМП преобладает поллакиурия (90,5%), ноктурия отмечается в 79,7% случаев, ургентный позыв – в 1,6 раза реже, симптомы ургентного НМ отмечались только у 19 пациенток (в 7,5 раза реже).
Анализ степени тяжести стрессового компонента показал практически одинаковое соотношение частоты легкой и средней степеней (50 и 44,5% соответственно). На долю тяжелой степени стрессового НМ приходится лишь 5,5% случаев.
Несмотря на то, что появление учащенных дневных и ночных мочеиспусканий, ургентного НМ, а также легкую степень стрессового НМ большинство женщин в постменопаузе расценивают как возрастную норму, не требующую специального обращения к врачу, все опрошенные считают данные симптомы причиной снижения качества жизни. Наибольшее влияние на качество жизни, требующее изменение образ жизни, оказывают ургентное НМ и тяжелая степень стрессового НМ.
Оценка степени атрофии урогенитального тракта с помощью индекса вагинального здоровья (табл. 1) выявила наличие атрофических изменений различной степени тяжести у всех женщин с симптомами ГМП в постменопаузе (основная группа), в группе контроля этот показатель составил 43% (р<0,05).
Наибольшее количество женщин (47,2%) имело выраженную атрофию слизистой влагалища, характеризующуюся слабой эластичностью, скудным транссудатом, щелочным уровнем рН (5,6–6,0), сухостью и кровоточивостью при заборе материала на исследование. Умеренные атрофические изменения (средняя эластичность, поверхностный транссудат, рН 5,1–5,5, минимальная сухость, кровоточивость при интенсивном заборе материала) встречались в 24,3% случаев. У 8 (11,4%) женщин диагностировалась высшая степень атрофии, проявляющаяся отсутствием эластичности, транссудата, наличием петехиальных кровоизлияний, рН>6,1, выраженной сухости и воспалительных изменений слизистой. Незначительная степень атрофии выявлялась в 17,1% случаев, данная группа была представлена женщинами с длительностью постменопаузы менее 6 лет.
Помимо стандартного лабораторного и гинекологического обследования всем пациенткам проводилось КУДИ. В ходе проведения урофлоуметрии установлено значимое изменение основных количественных показателей у женщин с симптомами ГМП, по сравнению с контрольной группой (р<0,05). Средние показатели объема выделенной мочи и времени мочеиспускания были снижены в основной группе и составили 98,5±26,1 мл и 4,9±1,5 сек соответственно. Средние показатели времени достижения максимального потока мочи были повышены до 1,8±0,7 сек. Установлено, что урофлоуметрия дает косвенную информацию о сократительной способности детрузора. Изменение значений показателей урофлоуграмм может быть следствием снижения физиологического объема мочевого пузыря, что возможно при ГМП.
При качественной оценке урофлоуграмм нормальный тип мочеиспускания выявлен у 47 (67,1%) женщин; прерывистый тип, обусловленный вовлечением в акт мочеиспускания мышц передней брюшной стенки и периуретральных мышц, наблюдался у 3 (4,3%) женщин. У 20 (28,6%) пациенток был установлен стремительный тип мочеиспускания, характерный для ургентного НМ.
При цистометрии наполнения выявлено значимое снижение цистометрической емкости мочевого пузыря у пациенток с ГМП, по сравнению с группой контроля (р<0,001). В 52,9% (n=37) диагностирована гиперактивность детрузора. Фазовая детрузорная гиперактивность наблюдалась у 31 (44,3%) пациентки основной группы, она характеризовалась волнообразным типом сокращений и в 8,6% случаев заканчивалась ургентным НМ. Терминальная детрузорная гиперактивность, проявляющаяся непроизвольным сокращением детрузора при достижении цистометрической ёмкости, выявлялась у 6 (8,6%) женщин и заканчивалась непроизвольным мочеиспусканием у 5 (7,1%) женщин.
В ходе исследования давление-поток и профилометрии уретры данных за инфравезикальную обструкцию, нейрогенную дисфункцию нижних мочевых путей и признаков недостаточности замыкательного аппарата уретры получено не было.
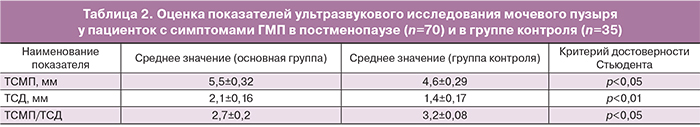
Ультразвуковая оценка возможных специфических для гиперактивности детрузора показателей проводилась при помощи трехмерного высокочастотного вагинального датчика с частотой 3,5–6 Мгц (General Electric) аппарата Voluson 730 после мочеиспускания при объеме мочи 50 мл. В процессе обследования определяли толщину стенки мочевого пузыря (ТСМП), толщину стенки детрузора (ТСД), их соотношение (ТСМП/ТСД). ТСМП представляла три слоя стенки мочевого пузыря – слизистая оболочка, детрузор и адвентиция. ТСМП измерялась в трех точках (треугольник Льето, передняя стенка и дно мочевого пузыря), после чего рассчитывалось среднее значение показателя (табл. 2) [4].
Отмечено, что в группе пациенток с симптомами ГМП значения ТСМП колебались от 5,1 до 5,9 мм. У пациенток с гиперактивностью детрузора (n=37, 52,9%), подтвержденной уродинамическим исследованием, этот показатель был несколько выше и составил 5,5–5,9 мм (в среднем 5,7±0,11 мм). Значения ТСД у женщин основной группы составили 1,9–2,3 мм, в подгруппе пациенток с гиперактивностью детрузора – 2,1–2,3 мм (в среднем 2,2±0,07 мм). Выявлено, что эхографические показатели ТСМП, ТСД у пациенток с симптомами ГМП в постменопаузе были статистически значимо выше, а отношение ТСМП/ТСД – ниже, по сравнению с таковыми у женщин контрольной группы. Полученные данные позволяют предположить наличие гипертрофических изменений детрузора при развитии ГМП и подтверждают диагностическую ценность ультразвукового метода. Установлена сильная прямая корреляционная зависимость между повышением значений ТСМП более 5 мм, а ТСД более 2 мм и наличием симптомов ГМП (r=0,84; r=0,67 соответственно, р<0,01). Показана умеренная прямая зависимость между указанными показателями и выявлением уродинамической гиперактивности детрузора (r=0,35; r=0,33 соответственно, р<0,01).
Таким образом, увеличение показателей ТСМП более 5 мм и ТСД более 2 мм является возможным признаком гипертрофии детрузора, что может быть следствием гиперактивности детрузора и клинически проявляться симптомами ГМП. Наиболее выраженные изменения ТСМП и ТСД выявлялись у женщин с ургентным НМ. Снижение отношения ТСМП/ТСД у пациенток основной группы закономерно и объясняется неизменными значениями толщины слизистой оболочки мочевого пузыря и адвентиции у женщин обеих групп при увеличенной толщине детрузора у пациенток с симптомами ГМП.
Заключение
Распространенность нарушений мочеиспускания у женщин в постменопаузе составляет 41,9%, доминируют симптомы ГМП (39,3%).
Объективное обследование женщин с симптомами ГМП в постменопаузе подтвердило превалирование частоты поллакиурии и ноктурии. У всех женщин основной группы присутствовали атрофические изменения слизистой влагалища (р<0,05), доминировала выраженная степень атрофии (47,2%). Показано, что степень тяжести вульво-вагинальной атрофии коррелирует с возрастом и продолжительностью постменопаузы.
Выявлено значимое изменение основных количественных и качественных показателей урофлоуграммы у женщин с симптомами ГМП. При проведении цистометрии наполнения отмечено снижение цистометрической емкости мочевого пузыря у пациенток с ГМП (р<0,001), в 52,9% случаев выявлена гиперактивность детрузора. Наши результаты совпадают с литературными данными, согласно которым детрузорная гиперактивность может не выявляться у ряда больных с клиническими признаками ГМП [5].
Наше исследование показало, что факторами риска развития нарушений мочеиспускания у женщин в постменопаузе являются: возраст 60–64 года, длительность постменопаузы более 6 лет, величина ИМТ более 25 кг/м2, роды через естественные родовые пути, симптомы заболевания до наступления менопаузы. Отмечается прямая зависимость между симптомами вульво-вагинальной атрофии и нарушением мочеиспускания.
При ультразвуковом исследовании мочевого пузыря отмечалось значимое увеличение показателей ТСМП и ТСД, а также снижение отношения ТСМП/ТСД у женщин с симптомами ГМП в постменопаузе (р<0,05). Полученные результаты позволяют рассматривать данный метод как возможность скрининга гипертрофических изменений детрузора, а следовательно, гиперактивности детрузора и симптомов ГМП.



