Пролапс тазовых органов (ПТО) в ряду актуальных гинекологических проблем занимает важное место. Статистический анализ, проведенный различными клиниками, выявил удручающие данные: у пациенток возрастной группы от 50 до 80 лет ПТО выявляется в 35–50% наблюдений [1–3]. ПТО крайне негативно отражается на качестве жизни женщин и представляет серьезную социальную и медицинскую проблему. Одним из самых распространенных осложнений ПТО является стрессовое недержание мочи (СНМ) [4]. По наблюдениям ряда авторов, наличие данного осложнения у пациенток с ПТО отмечается в 40–63% наблюдений [5, 6]. Основным методом лечения ПТО является хирургический [7–10]. При наличии расстройств мочеиспускания проводится комбинированное лечение ПТО с одновременным выполнением слинговых операций. Актуальным является рассмотрение вопроса о самодостаточном лечении ПТО и, как следствие, недержания мочи при помощи сетчатых имплантов, которое, по мнению ряда авторов, приводит к коррекции недержания мочи за счет восстановления анатомически правильного расположения органов малого таза [11]. Однако данная проблема не имеет однозначного решения, зависит от вида и степени недержания мочи, что обуславливает необходимость дальнейших исследований по данной теме [12, 13]. В литературе нет широкого обсуждения проблем, посвященных изучению ультразвуковых маркеров ПТО, а также сопряженных с ними проблем инконтиненции [7, 14]. В диагностический алгоритм обследования данных больных ультразвуковое исследование (УЗИ) до настоящего времени не включено [12, 13].
Цель настоящего исследования: повышение эффективности хирургического лечения сочетанных форм ПТО и СНМ сетчатыми имплантами на основании трансперинеального и 3D-УЗИ.
Материалы и методы
Проведен анализ хирургического лечения сочетанных форм ПТО и недержания мочи при помощи сетчатых имплантов за период с 2017 по 2022 гг. на базе ГКБ № 31. В исследование включена 51 пациентка в возрасте 55±3,0 года, страдающая сочетанной формой ПТО и СНМ. Из них жалобы на недержание мочи легкой степени предъявляли 15, средней – 19, тяжелой – 17 больных. Контрольную группу составили 32 пациентки без признаков ПТО и недержания мочи. Коррекция пролапса гениталий была осуществлена сетчатым имплантатом InGYNious 15 пациенткам со 2-й степенью ПТО, 11 – с 3-й степенью, имплантом OPUR – 11 больным со 2-й степенью ПТО, 14 – с 3-й степенью пролапса.
Всем больным до операции проведено стандартное обследование, которое включало оценку общего состояния, в т.ч. общеклиническое обследование, гинекологический осмотр с определением степени опущения по классификации POP-Q, проводилась ультразвуковая оценка степени пролапса до операции, оценивалась анатомия малого таза на 3-и сутки послеоперационного периода, а также спустя 3, 6 и 12 месяцев после операции.
Ультразвуковое исследование (УЗИ) органов малого таза мы проводили на аппарате Canon Aplio MX SSA-780A, снабженном программным обеспечением 3D/4D, с использованием объемного трансвагинального датчика (6,0 Мгц), который устанавливался на промежность в преддверие влагалища в положении пациентки в гинекологическом кресле с поднятыми и согнутыми ногами, угол наклона спинки которого составлял 30°. Исследование происходило при наполнении мочевого пузыря не более 100–150 мл, что позволяло получать адекватные срезы мочеиспускательного канала, мочевого пузыря, пубовезикальной фасции, прямой кишки и костных структур. Угол положения датчика не должен был превышать 45°, исследование исключало компрессию датчиком, что стандартизировало получение срезов и исключало искажение необходимых маркеров. Для оценки анатомических факторов, влияющих на купирование и возникновение континенции, оценены предложенные М.А. Чечневой (2012) [14] двухмерные ультразвуковые маркеры в покое и с пробой Вальсальвы: α-угол (между продольной осью уретры и вертикальной осью тела), β-угол (между продольной осью уретры и задней стенкой мочевого пузыря), форма мочевого пузыря. В режиме трехмерной эхографии в обязательном порядке, помимо изучения уретры и ее сфинктеров, формы мочевого пузыря, исследовались наличие и структурность пубовезикальной фасции как определяющего фактора возникновения ПТО. Помимо стандартной мультиплоскостной реконструкции в режиме гинекологического исследования, мы использовали прицельно-сфокусированный режим Prostata, позволивший добиться анатомической визуализации пубовезикальной фасции. Также более углубленное исследование данной структуры мы производили в режиме TUI c заданным шагом сканирования 0,1–0,5 мм с обязательным изменением контрастности и насыщенности эхограммы. Аналогичные режимы мы использовали в послеоперационном наблюдении для более четкой презентации установленных слингов с целью определения особенностей их расположения и сопутствующих возможных осложнений.
Результаты и обсуждение
На первом этапе работы была проведена оценка УЗ-критериев у здоровых женщин (n=32), не страдающих пролапсом гениталий (таблица). Как видно из данных таблицы, показатель α-угла в покое составил 15,0±2,5°, что свидетельствует об анатомически правильном расположении передней стенки влагалища. При пробе Вальсальвы α-угол отклонялся на 20–25°, что указывает на отсутствие гипермобильности уретры и соответствует нормативным показателям топографии органов. Значения β-угла были 95,2±9,2° в покое и 105,3±7,3° при натуживании, что также транслировало правильное расположение передней стенки влагалища и отсутствие цистоцеле. Мочевой пузырь в данной группе пациенток имел округлую, слегка вытянутую форму, которая не менялась при натуживании.

Особое внимание уделялось изучению состояния тазовой фасции, которая, помимо соединительной ткани, содержит и мышечные волокна. Это неоднородный пласт соединительной ткани и мышечных клеток, местами истонченный, а местами значительной толщины за счет соединения с фиброзными тяжами мышц тазового дна. Составной частью тазовой фасции является пубовезикальная фасция, играющая определяющую роль в обеспечении нормальной статики тазовых органов и их функции. При ультразвуковом исследовании пубовезикальная фасция у пациенток контрольной группы визуализировалась в виде эхо-позитивной структуры линейной формы, толщиной 1,5–3 мм на границе между стенкой влагалища и задней стенкой мочевого пузыря и уретры. Учитывая особенности ее анатомии и локализации, возможности ее обнаружения и оценки толщины и структуры значительно повышаются при использовании эхо-усиленных режимов (Prostata, Testes) (рис. 1). Применение трехмерной эхографии в данной зоне сканирования целесообразно с использованием режима TUI (с заданным шагом сканирования 0,1–0,5 мм) с изменением контрастности сканирования для более четкой верификации наличия данной фасции или ее отсутствия. При 3D-сканировании фасция определялась также в виде нитевидой гиперэхогенной структуры, во фронтальном срезе определялась как вытянутая непрерывная структура повышенной эхогенности с линейными тенями (рис. 2). При 3D-реконструкции мы оценивали анатомо-функциональные параметры уретры и соотношение ширины сфинктера с площадью поперечного сечения уретры, которое составило в норме 0,8 (рис. 3). При пробе Вальсальвы указанные параметры оставались стабильными, обратный ток мочи не регистрировался.
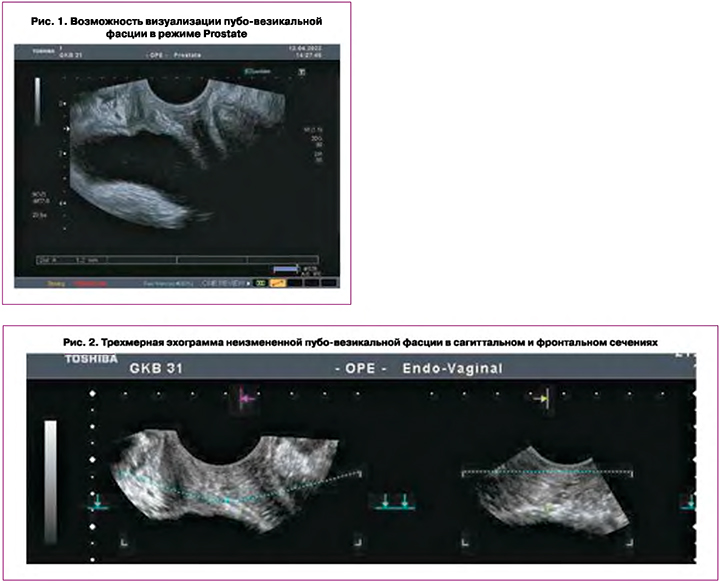
Проведенное пациенткам с ПТО на дооперационном этапе УЗИ показало, что на основании формы мочевого пузыря можно было заподозрить наличие или отсутствие дефекта тазовой фасции. При наличии дефектов фасции, выявленных при использовании режима TUI (Prostata) (рис. 4), форма мочевого пузыря у 9 пациенток со 2-й степенью по POP-Q и у 19 – с 3-й степенью по POP-Q имела неровный контур с формированием клиновидной инвагинации (рис. 5). Овоидная форма мочевого пузыря была диагностирована у 17 пациенток со 2-й степенью по POP-Q и у 7 – с 3-й степенью по POP-Q. Однако при пробе Вальсальвы было выявлено выпячивание задней стенки мочевого пузыря в виде «песочных часов» (рис. 6) у всех больных с 3-й степенью ПТО, что свидетельствовало о наличии скрытого дефекта фасции. Пубовезикальная фасция приобретала вид неровного, обрывистого тяжа с нечеткими, «рваными» краями, множеством хаотических линейных разрывов, местами полностью прерывалась. Дефект фасции наилучшим образом диагностировался при 3D-cканировании в режиме Prostata (рис. 7). Однако у одной пациентки, обратившейся к нам за оперативным лечением после двух пластических операций, кольпоперинеорафии, леваторопластики, с полным выпадением купола влагалища, при УЗИ пубовезикальная фасция местами определялась в виде линейных гиперэхогенных штрихов, местами вовсе не определялась, что говорит о полном исчезновении данной анатомической структуры.

Мы проводили стандартизацию УЗ-критериев ПТО в зависимости от степени. Оценка УЗИ маркеров ПТО и нарушения анатомического соотношения органов малого таза (α- и β-углы) выявила значительное отклонение данных показателей (рис. 9–12). Так, при 2-й степени по POP-Q α-угол составил в покое 28,5±3,0°, при натуживании – 67,2±2,8°, при 3-й степени – 46,1±5,7° в покое, при пробе Вальсальвы – 69,2±3,0°. Значения β-угла при 2 и 3-й степенях пролапса зафиксированы – 40,9±3,3° и 26,0±2,6° в покое, 54,9±3,0° и 33,2±2,6° при натуживании соответственно.
Установка сетчатых имплантов у всех пациенток прошла без интра- и ранних послеоперационных осложнений. По данным гинекологического осмотра, проведенного на 3–5-е сутки после операции, выявлено, что коррекция ПТО была достигнута у всех пациенток и сохранялась до 6 месяцев. У 6,7% пациенток с ПТО 3-й степени через 21 месяц после операции при гинекологическом осмотре был выявлен неполный эффект от установки сетчатого импланта – диагностирована 2-я степень.
Анализ эхографической картины задней стенки мочевого пузыря после операции выявил, что у пациенток, независимо от степени ПТО, форма мочевого пузыря была восстановлена за счет импланта, который визуализировался в виде эхопозитивной структуры толщиной 2–3 мм с акустическим сигналом на границе между перешейком и задней стенкой мочевого пузыря, при фронтальном сканировании уходящим в зону параметрия, создающим стабильную поддержку нарушенной фасции мочевого пузыря и имитирующим эхографическую структуру пубовезикальной фасции (рис. 8). Так, из 28 пациенток с остроугольной инвагинацией на дооперационном этапе у 7 женщин после операции мочевой пузырь приобрел овальную форму с ровными, четкими краями, при натуживании не претерпевал изменений. У 21 больной мочевой пузырь имел овальную форму с волнообразными, нечеткими краями за счет ребер жесткости импланта, при пробе Вальсальвы мочевой пузырь распрямлялся, приобретая ровные края.
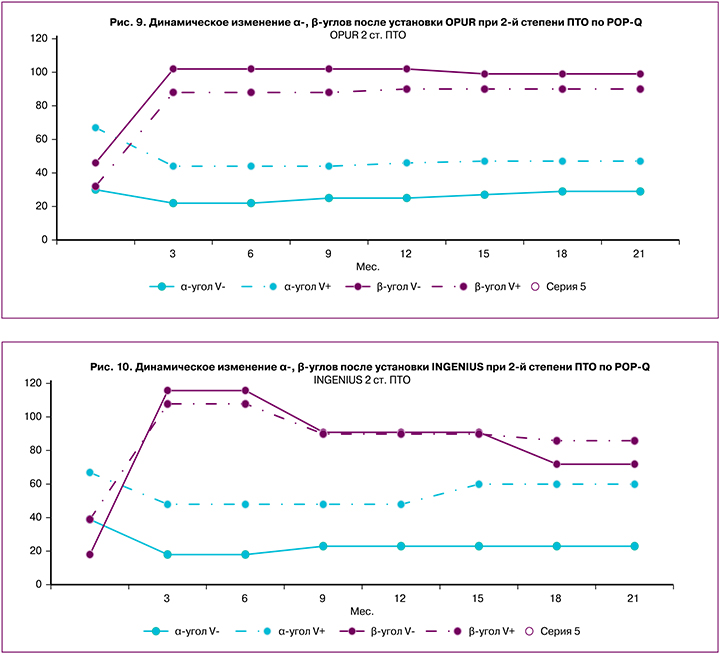
Независимо от вида импланта по данным УЗИ отмечена отчетливая тенденция к нормативным показателям α- и β-углов после установки сетчатого импланта. Как видно из рисунка 10, угол α уменьшался в 1,4–2,0 раза, что свидетельствовало об адекватной репозиции передней стенки влагалища. Угол β увеличивался в 2,0–2,4 раза в покое и в 2,3–3,0 раза при натуживании, что также доказывало коррекцию анатомических параметров и нивелирования цистоцеле. Гипермобильность уретровезикального сегмента скорректировалась у 59%, осталась выраженной у 41% женщин. У большинства пациенток данный показатель не претерпевал значительных изменений в течение 21 месяца наблюдений.
Оценивая результаты лечения сетчатыми имплантами ПТО 2 и 3-й степени по данным гинекологического осмотра и УЗИ, мы обнаружили высокую эффективность данного вида хирургического лечения.
Изучив клинические проявления СНМ после коррекции ПТО, мы выявили, что после имплантации сетки из 51 больных со СНМ у 17 и 13 пациенток с 2 и 3-й степенью по POP-Q соответственно зарегистрирована положительная динамика. Инконтиненция купировалась самостоятельно в течение 3 месяцев после операции: у 14 и 7 пациенток с 2 и 3-й степенью пролапса соответственно сохранялись жалобы на подтекание, недержание мочи при физической нагрузке. Следует отметить, что из 21 пациентки со 2-й степенью пролапса (4 со средней и 8 с тяжелой формой) недержание мочи после операции снизилось до легкой степени. Тяжелая степень СНМ после операции сохранилась у 2 и 7 больных с 2 и 3-й степенью ПТО соответственно.
Как видно из данных исследования, которые отражены на графиках (рис. 9–12), у пациенток с купированным недержанием после установки сетчатого импланта зарегистрирована коррекция α-угла с 39±3,2° до 20±3,0° при 2-й степени ПТО. При 3-й степени ПТО коррекция угла α была еще более значительной: зарегистрировано уменьшение с 44±3,0° до 23±5,1°, что указывало на восстановление анатомии передней стенки влагалища.
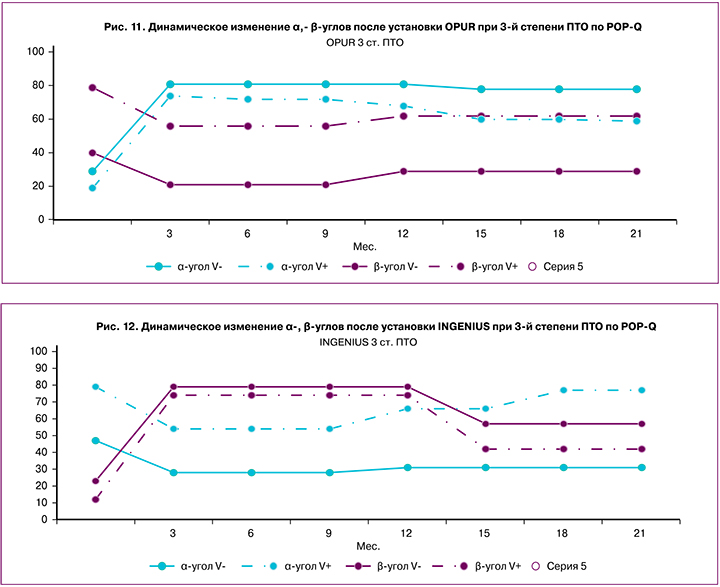
Учитывая большой разброс числовых значений β-угла в нашем исследовании, мы пришли к выводу, что он, являясь маркером ПТО, не является маркером инконтиненции.
Важным УЗ-маркером оценки недержания мочи считаем изменение угла α при пробе Вальсальвы, которое свидетельствует о гипермобильности уретры и является одной из причин инконтиненции. Так, после установки сетчатых имплантов мы отметили у 30 пациенток с купированной инконтиненцией нивелирование гипермобильности уретры: при натуживании отклонение угла α уменьшалось с 26 до 9° при 2-й степени пролапса и с 30 до 18° при 3-й степени ПТО, что соответствовало нормативным показателям.
У 21 пациентки с сохранившейся инконтиненцией после установки сетчатых имплантов при детальном анализе выявлено, что, несмотря на визуальное отсутствие при гинекологическом осмотре опущения передней стенки влагалища, по данным УЗИ α-угол имел значительное отклонение от нормативных показателей: 40±3,0° в покое, при натуживании 78±3,0° при 2-й степени ПТО и 45±3,3⁰ в покое, при пробе Вальсальвы 90±3,0° при 3-й степени ПТО.
У всех пациенток (21) отмечалось изменение α-угла при пробе Вальсальвы более чем на 40°, что указывало на выраженную гипермобильность уретры, клинически это имело проявление в виде подтекания мочи при нагрузке.
Помимо оценки α-угла при УЗИ мы изучили сохранность сфинктера уретры. Так, из 21 пациентки с сохранившейся инконтиненцией у 6 при 3D-УЗИ на фоне пробы Вальсальвы выявлена дилатация уретры в проксимальном отделе до 1,2 см (норма до 0,8 см), что указывало на несостоятельность уретрального сфинктера. В режиме допплерометрии, в серошкальном изображении мы регистрировали реверсивный ток мочи из уретры в мочевой пузырь за счет инверсии уретрально-пузырного градиента давления.
СНМ тяжелой степени снижало качество жизни, в связи с чем данным пациенткам была показана установка TVT-О вторым этапом после первой операции.
Заключение
Проведенное исследование показало, что ПТО является многофакторной проблемой. Помимо диспозиции тазовых органов, у большинства пациенток наблюдается та или иная форма инконтиненции на дооперационном этапе. Проведенный анализ сочетанных форм ПТО и СНМ выявил положительное влияние установки сетчатых имплантов при ПТО на купирование СНМ. Восстановление пубовезикальной фасции и нормопозиции тазовых органов приводило по данным УЗИ к уменьшению мобильности уретры и купированию СНМ у большинства пациенток (59%).
У 23,5% больных отмечалось снижение степени инконтиненции до легкой формы и трактовалось нами как неполный эффект. У 17,6% пациенток со СНМ коррекция инконтиненции не была достигнута, в связи с чем им потребовалась установка TVT-O.
Помимо оценки анатомических маркеров ПТО (а-, β-углов, наличия или изменения пубовезикальной фасции, формы мочевого пузыря), проведение УЗИ позволяет выстроить прогноз относительно инконтиненции у пациенток с ПТО на основании определенных эхографических признаков. Так, выявленная до операции гипермобильность уретры более чем на 45° предполагает отсутствие коррекции СНМ после установки сетчатых имплантов. Сочетание данного УЗ-критерия с дилятацией сфинктера уретры и ретроградным током мочи дает пессимистичный прогноз в отношении инконтиненции.
Таким образом, УЗИ в пред- и послеоперационном периоде позволяет оценить уровень и степень тяжести анатомических нарушений, эффективность установки сетчатых имплантов, выявить УЗ-маркеры инконтиненции и наличие гематом.
УЗИ является высокоинформативным методом диагностики не только пролапса гениталий у женщин, но и СНМ. Внедренный нами алгоритм УЗИ с оценкой пубовезикальной фасции, а-, β-углов, формы мочевого пузыря позволяет дать прогностическую оценку лечения сочетанных форм ПТО и СНМ.
Для оценки степени пролапса и проблем, связанных с инконтиненцией, необходимы методический подход и проведение УЗИ экспертного уровня в рамках определенного алгоритма.



