Спонтанный разрыв аневризмы яичниковой артерии происходит крайне редко, но может приводить к такому жизнеугрожающему состоянию, как забрюшинное кровотечение и образование гематомы [1]. Большинство случаев связано с беременностью и происходят либо на поздних сроках беременности, либо в раннем послеродовом периоде. В зарубежной литературе с 1963 по 2020 гг. было описано всего 25 случаев данного осложнения [1]. В последнее время также стали появляться обзоры редких случаев разрыва аневризмы яичниковой артерии, которые напрямую не были связаны с беременностью [2]. Этиология аневризм до сих пор до конца не изучена. Согласно данным литературы, разрывы аневризмы яичниковой артерии в более 50% случаев связаны с беременностью у женщин моложе 40 лет [3, 4]. Гемодинамические и эндокринные изменения во время беременности могут быть причиной артериальных изменений, которые приводят к образованию новой аневризмы или ослаблению ранее существовавших аневризм [4, 5]. Локальные колебания артериального давления в аорте и яичниковых артериях, вызванные увеличением матки и расширением сосудов малого таза в сочетании с увеличением кровотока в матке, усиливают механическое давление на стенки сосудов, что приводит к локальному повреждению [6]. Высокие уровни стероидных гормонов, особенно эстрогенов, циркулирующих во время беременности и в раннем послеродовом периоде, усиливают патологические изменения в стенках артерий [6]. В период гестации под действием стероидных гормонов фето-плацентарного комплекса изменяется эластичный слой сосудов, что приводит к нарушению целостности стенки, иногда – к аневризме и к спонтанным разрывам [6]. Нарушение нормального процесса обратного развития яичниковой артерии после родов также может предрасполагать к образованию аневризмы [7]. К факторам риска относится паритет женщины; с каждой повторной беременностью происходят гемодинамические и эндокринные изменения, которые могут вызвать изменения в стенках артерий и тем самым усугубить аневризму или разрушить ранее существовавшую [8]. Гипертоническая болезнь, заболевания соединительной ткани также относятся к факторам риска спонтанного разрыва аневризмы. Разрыв аневризмы сопровождается образованием забрюшинной гематомы. Забрюшинная гематома может быть опасной для жизни и требует неотложной хирургической помощи. Наиболее частыми причинами являются травма живота, повреждения сосудов во время хирургических вмешательств, а также разрывы аневризмы аорты или почечной артерии, опухоли забрюшинного пространства или нарушения системы свертывания крови [9]. Клиническая картина неспецифична; необходимо проводить дифференциальную диагностику с пиелонефритом, мочекаменной болезнью. При данной патологии появляются острая боль в животе или в боку, нарушение гемодинамики – тахикардия, гипотензия, бледность кожных покровов. У беременных пациенток в III триместре необходимо также исключать преждевременную отслойку нормально расположенной плаценты или разрыв матки [10]. Диагностика заключается в исследовании общего анализа крови (степень гемодинамических нарушений), коагулограммы (для исключения патологии свертывающей системы), ультразвуковом исследовании органов малого таза (для исключения других источников кровотечения). Золотым стандартом для выявления аневризм является компьютерная томография с введением внутривенного контраста. Компьютерная томография позволяет обнаружить большую гематому и активную экстравазацию внутривенного контраста в забрюшинное пространство [1].
В настоящее время нет определенной тактики ведения пациенток с разрывом аневризм яичниковых артерий; это редкое осложнение может привести к жизнеугрожающему кровотечению и летальному исходу без своевременной диагностики и лечения. В литературе в основном описаны случаи эмболизации и хирургического вмешательства [11, 12]. Эмболизация яичниковых артерий успешно применяется с 1990 г., когда впервые был опубликован случай лечения пациентки с разрывом аневризмы. Ранее при забрюшинных гематомах проводилась лапаротомия с перевязкой яичниковой артерии и аднексэктомией [13]. Эмболизация сосудов при данной патологии обладает рядом преимуществ: процедуру можно провести уже во время селективной ангиографии; меньшая инвазивность по сравнению с хирургическим вмешательством позволяет избежать шокового состояния; кроме того, эмболизацию сосудов можно провести, когда источник кровотечения неясен по компьютерной томографии [14]. В каждом случае должен быть индивидуальный, мультидисциплинарный подход. Учитывая оперативность и меньшую инвазивность, эндоваскулярное лечение считается приоритетным, особенно при стабильной гемодинамике пациентки [14]. Разрыв аневризмы в основном происходит с одной стороны, но также описаны случаи с двусторонней аневризмой яичниковых артерий с разрывом одной из аневризм [15]. В таком случае первым этапом проведено интервенционное радиологическое дренирование с последующей артериальной эмболизацией и хирургической эвакуацией гематомы [15]. Что касается дальнейшей фертильности женщин после проведенной эмболизации артерий яичников, то необходимо дальнейшее изучение данного вопроса. В литературе зафиксирован случай успешного наступления беременности после односторонней эмболизации яичниковой артерии [8].
Клиническое наблюдение
Пациентка З., 39 лет, из анамнеза: роды самостоятельные на сроке 40 недель крупным плодом. После родоразрешения на 2-е сутки стала отмечать боли в правой поясничной области. На 5-е сутки выписана домой с ребенком в удовлетворительном состоянии. На 6-е сутки отмечен подъем температуры до 37,5°С, боли в правой поясничной области не уменьшились. Принимала нестероидные противовоспалительные средства – без эффекта. На 9-е сутки обратилась в районную больницу, проведена рентгенография, по которой обнаружена забрюшинная гематома. По лабораторным данным – гипохромная анемия 1-й степени. По линии санитарной авиации пациентка переведена в Республиканскую клиническую больницу. Беременность 4-я, желанная, на учете состояла, беременность протекала без осложнений. В анамнезе 2 родов в срок, 1 медицинский аборт по желанию на малом сроке беременности. Менструации установились в 13 лет, регулярные, безболезненные, умеренные. Хронические заболевания, подъемы артериального давления отрицает. В анамнезе произведена диатермокоагуляция по поводу эрозии шейки матки.
При поступлении в отделение гинекологии Республиканской клинической больницы состояние удовлетворительное, активна, сознание ясное, по шкале Глазго 15 баллов. Жалобы на субфебрильную лихорадку и неинтенсивные боли в нижних отделах живота ноющего характера, больше справа и в правой поясничной области. Кожные покровы и видимые слизистые чистые, физиологической окраски. Язык влажный, чистый. Периферические лимфоузлы не увеличены. Физиологические отправления в норме. Живот мягкий, правильной формы, болезненный в правых отделах. Молочные железы мягкие, отделяемое – молоко. Отмечается болезненность при пальпации и поколачивании в правой поясничной области. АД 100/60 мм рт. ст., пульс 88 в минуту, температура 36,9°С. При влагалищном осмотре: наружные половые органы развиты правильно, ушитая рана (разрыв влагалища) – шов чистый. Слизистая влагалища гиперемирована, наружный зев щелевидный. Осмотр в зеркалах: шейка матки цилиндрическая, длиной 2 см, на 3 и 9 часах разрывы, на 0,5 см не доходящие до свода справа, слева доходят практически до свода. При бимануальном исследовании: влагалище свободное, шейка матки неравномерно сокращена до 2,5 и до 1,5 см за счет разрывов на 3 и 9 часах, мягкая, проходима для 1 см за внутренний зев. Тело матки плотноватое, увеличено до 13–14 недель, болезненное по правому ребру, подвижное. Граница правого ребра матки четко не пальпируется за счет болезненного образования, исходящего из правого ребра на всем протяжении. Область придатков – без особенностей, тракции за шейку безболезненные. Выделения – лохии. Стенки таза при пальпации безболезненные. По РКТ правая почка смещена кпереди за счет забрюшинной гематомы максимальными размерами до 103×56×166 мм; в артериальную фазу от аорты ниже правой почечной артерии отходит мелкая артерия, входящая в толщу гематомы; на дальнейших фазах контраст затекает в гематому, отмечается связь контрастируемой гематомы с извитой правой яичниковой веной – артерио-венозная мальформация. Брюшной отдел аорты, другие крупные сосуды брюшной полости без патологических изменений. Лимфатические узлы брюшной полости и забрюшинного пространства не увеличены. Свободная жидкость не обнаружена. Матка увеличена в размерах, в полости – сгусток крови. По данным ультразвукового исследования (УЗИ) тело матки 105×85×102 мм, положение в anteflexio-versio. Миометрий неоднородный. Полость матки расширена до 30 мм, в полости матки визуализируются гипоэхогенные участки (вероятно, сгустки). Длина шейки 30 мм, цервикальный канал расширен до 2 мм. Яичники на момент осмотра не визуализируются. Жидкость в позадиматочном пространстве не определяется. Справа визуализируется гипоэхогенный участок с неровными нечеткими контурами, с неоднородным содержимым размерами 160×100×100 мм (объем 350–400 см3) (рис. 1).

По лабораторным данным при поступлении: лейкоциты 8,6×109/л, эритроциты 3,15×1012/л, гемоглобин 98 г/л, гематокрит 26,8%, тромбоциты 343×109/л, протромбиновое время 12,2 с, процент протромбина по Квику 97,1%, МНО 1,01, фибриноген 3,00 г/л, АЧТВ 30,8 с, прокальцитонин 0,28 нг/мл, в бактериологическом посеве из половых путей выявлена Escherichia coli 104. Для уточнения диагноза и исключения данных за продолжающееся кровотечение в забрюшинную гематому показана экстренная ангиография. При проведенной диагностической ангиографии выявлена аневризма правой яичниковой артерии в стадии разрыва с исходом в забрюшинную гематому (рис. 2).
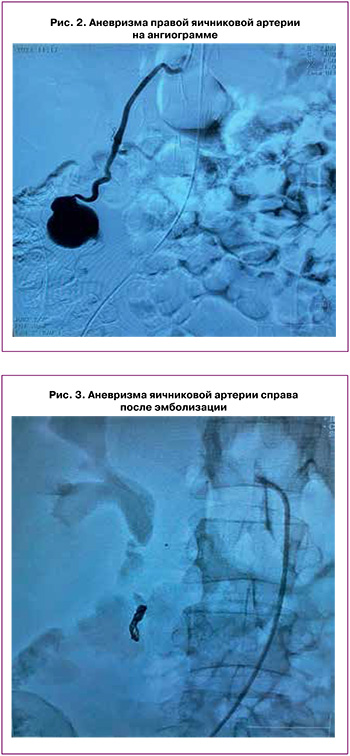
С учетом кровоснабжения аневризмы яичниковой артерии из системы маточных артерий, принято решение провести эмболизацию маточных артерий и эмболизацию правой яичниковой артерии; также начата антибактериальная терапия с учетом выявленной микрофлоры. В ходе ангиографии выявлено, что диаметр маточных артерий слева и справа без особенностей. Произведена эмболизация дистальных отделов маточной артерии сферами 355-500-1 фл. На контрольных ангиограммах: окклюзия дистальных сегментов маточной артерии. На ангиограммах контрастируется аневризматическое расширение с усиленным накоплением контрастного вещества, овальной формы, размерами 35×45 мм. Произведена селективная катетеризация правой яичниковой артерии. В артерию введены микроспираль Нelixev 38 mm×30 cm и дополнительная эмболизация микросферами 1000-1180-1фл. При контрольной ангиографии: замедлен кровоток по правой яичниковой артерии, стаз – контраст в аневризме (рис. 3).
На следующий день достоверных изменений объема забрюшинной гематомы не было, боли в пояснице постепенно уменьшились, жизненные показатели стабилизировались. На 2–4-е сутки у пациентки наблюдалась субфебрильная температура, сохранялись боли в правой половине поясницы со значительно меньшей интенсивностью. На 5-е сутки после проведенной эмболизации маточных артерий по УЗИ – в забрюшинном пространстве справа визуализируется плотная гематома 108×41 мм, кровоток в ней не определяется, спереди к ней примыкает заполненная сгустками, заэмболизированная аневризма размерами 65×25 мм, в нижней трети в ней определяется дефект 50 мм, заполненный сгустками, идентичными с забрюшинной гематомой. Правая почка развернута, смещена кверху забрюшинной гематомой, лоханочно-мочеточниковый сегмент расширен до 13 мм за счет сдавления забрюшинной гематомой. Тело матки 82×62×75 мм. Миометрий: передняя стенка утолщена за счет диффузно-очагового аденомиоза. Полость матки практически не расширена. В нижнем сегменте просвет 5 мм, контуры передней стенки полости матки неровные. Концентрация гемоглобина увеличилась до 110 г/л. В послеоперационном периоде продолжена консервативная антибактериальная терапия, дальнейшее хирургическое вмешательство не потребовалось. Пациентка выписана на 11-е сутки лечения в удовлетворительном состоянии с рекомендациями контроля УЗИ в динамике.
Заключение
Разрыв аневризмы яичниковой артерии требует своевременной диагностики и эффективного лечения, а также мультидисциплинарного подхода. Хотя в литературе немного описанных случаев со спонтанным разрывом яичниковых артерий, эмболизацию яичниковых артерий можно рассматривать, как вариант лечения первой линии, если гемодинамические показатели стабильны.



