Актуальность
Железодефицитная анемия (ЖДА) – это приобретенное полиэтиологическое заболевание, характеризующееся снижением содержания железа в сыворотке крови, костном мозге и тканевых депо, в результате чего нарушается образование гемоглобина и эритроцитов, развиваются гипохромная анемия и трофические расстройства в тканях.
Латентный дефицит железа (ЛДЖ) – это состояние, характеризующееся истощением запасов железа в организме при нормальном уровне гемоглобина.
По данным ВОЗ, диагноз анемии устанавливается у 32% женщин репродуктивного возраста и у 40% беременных [1]. Анемия – наиболее часто встречающееся состояние при беременности: диагноз заболевания устанавливается в РФ у каждой третьей беременной, без существенного снижения частоты заболевания за последние годы. При анемии у беременной существенно увеличивается частота осложнений гестационного процесса, отмечаются более частые нарушения состояния плода, новорожденного, детей первых лет жизни.
Анемия остается неразрешимой проблемой, свидетельствующей о несправедливом гендерном здоровье [2], являясь одной из основных причин, характеризующих показатель DALY (Disability-adjusted life years/годы жизни, скорректированные по нетрудоспособности) – показатель, оценивающий суммарное «бремя болезни» [3].
При анемии у женщин репродуктивного возраста гемоглобин (Hb) снижается до значений менее 120 г/л, во время беременности – менее 110 г/л (по рекомендациям ВОЗ) (таблица), в ряде стран во II триместре беременности – менее 105 г/л; в послеродовом периоде – менее 100 г/л [4, 5].

Причины формирования ЛДЖ И ЖДА у женщин репродуктивного возраста
Причины формирования ЛДЖ и ЖДА в репродуктивном возрасте и в период беременности многочисленны. К числу наиболее частых причин относят: нарушения всасывания/поступления железа, хронические кровопотери (у женщин репродуктивного возраста – наиболее часто вследствие аномальных маточных кровотечений) и повышенную потребность в железе. Дефицит железа в организме обусловливает нарушения метаболизма и приводит к формированию клинических и лабораторных проявлений, выраженность которых зависит от стадии дефицита железа.
ЛДЖ и ЖДА у беременных обусловлены повышенным потреблением железа матерью и плодом на фоне его недостаточного экзогенного поступления и/или усвоения и встречаются в любом сроке беременности. Дефицит железа служит наиболее распространенной причиной анемии у беременных, тем более что до 40% женщин имеют нарушения обмена железа в предгравидарном периоде. В общей сложности для нормально протекающей беременности дополнительно требуется около 1000 мг железа, что соответствует поступлению 6,3 мг железа в сутки. Кроме того, в период лактации требуется дополнительное поступление 1 мг железа в сутки [6].
Клиническая характеристика ЛДЖ и ЖДА
Основными клиническими проявлениями ЖДА являются гипоксический/анемический и сидеропенический синдромы. Гипоксический синдром включает общие для всех анемий симптомы: бледность, усиленное сердцебиение, шум в ушах, головная боль, одышка при физической нагрузке, сонливость, слабость. К проявлениям сидеропенического синдрома относятся сухость кожи, изменение ногтей, выпадение волос, извращения вкуса, ангулярный стоматит, диспептический синдром. Многообразие клинических симптомов дефицита железа связано с широким спектром метаболических нарушений, к которым приводит дисфункция железосодержащих и железозависимых ферментов. Изолированные или комбинированные проявления умеренных симптомов сидеропенического синдрома характерны для ЛДЖ.
Беременность при ЖДА обусловливает увеличение частоты гестационных и перинатальных осложнений [7], характеризуется нарушениями белкового обмена, дистрофическими проявлениями в миометрии, гипоплазией плаценты, снижением синтеза гормонов; повышением частоты преэклампсии, угрозы прерывания беременности, частоты преждевременных родов, увеличением частоты задержки роста плода, повышением частоты слабости родовой деятельности, гипотонических кровотечений; большей частотой гнойно-септических осложнений, гипогалактии, уменьшением длительности лактации. Отмечено более частое развитие геморрагического шока при кровотечениях. Установлена корреляция между наличием низкого уровня железа и большей по сравнению с нормой массой плаценты и пониженным плодово-плацентарным коэффициентом.
При концентрации Hb менее 100 г/л при первом антенатальном визите риск мертворождения/перинатальной гибели возрастает в 5 раз по сравнению с беременными с нормальным уровнем Hb. При концентрации Hb менее 100 г/л в 28 недель риск мертворождения/перинатальной гибели в 3 раза выше по сравнению с беременными с нормальным уровнем Hb [8].
Нормативные документы, регламентирующие диагностику и терапию ЛДЖ и ЖДА в РФ
Минздравом России утверждены клинические рекомендации «Железодефицитная анемия» (2021) [9]. Клинические рекомендации «Анемия, осложняющая беременность, деторождение и послеродовой период» находятся в настоящее время на этапе разработки.
Рациональная профилактика ЛДЖ и ЖДА
Согласно клиническим рекомендациям «Железодефицитная анемия» (2021), дополнительное назначение профилактических доз лекарственных препаратов железа лицам из группы риска развития ЛДЖ и ЖДА рекомендуется в случаях, когда невозможно устранить причину развития железодефицитного состояния (хроническая кровопотеря при аномальных маточных кровотечениях, заболеваниях желудочно-кишечного тракта, сопровождающихся нарушениями всасывания или рецидивирующими кровотечениями; пациентам на программном гемодиализе; пациентам с неоперабельными опухолями любой локализации, сопровождающимися рецидивирующими кровотечениями; взрослым лицам, соблюдающим вегетарианскую или веганскую диету; донорам, регулярно осуществляющим донации крови. «Рекомендуется проводить вторичную профилактику дефицита железа при каждом обращении пациента к врачу, проведении диспансеризации, медицинских осмотров. Профилактика железодефицита подразумевает проведение скрининговых исследований для выявления ЖДА или латентного железодефицита». Американский колледж акушеров-гинекологов рекомендует одно/двухэтапный ежегодный скрининг всех женщин репродуктивного возраста, с дифференцированным профилактическим назначением железа в случае выявления дефицита железа [10]. Согласно клиническим рекомендациям «Нормальная беременность» (2020), беременной пациентке при нормальном уровне гемоглобина и/или ферритина не рекомендовано рутинно назначать прием препаратов железа [11]. ВОЗ c 2012 г. рекомендует профилактический прием 30–60 мг элементарного железа в сутки для профилактики ЖДА всем беременным женщинам [12]. Рекомендации по раннему рутинному назначению железа также представлены Американским колледжем акушеров-гинекологов (2021) [13].
Современные методы диагностики ЛДЖ и ЖДА во время беременности
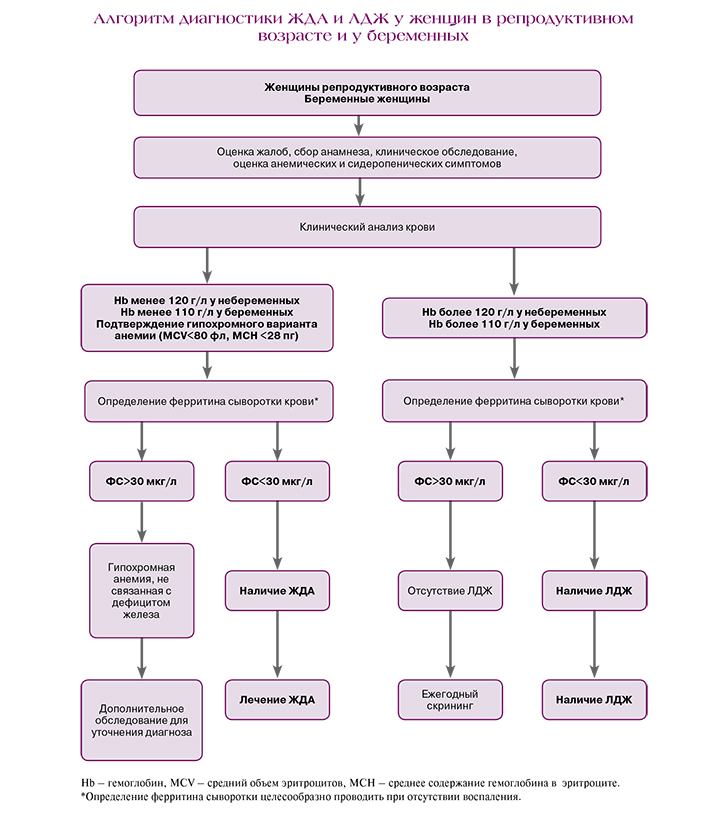
У всех пациентов с ЖДА необходимы выяснение причины развития ЖДА и диагностики сопутствующей патологии, проведение физикального обследования с акцентом на характерные признаки сидеропенического и анемического синдромов для верификации диагноза.
В клинических рекомендациях «Железодефицитная анемия» (2021) рекомендованы выполнение общего (клинического) анализа крови, оценка гематокрита (Hct), исследование уровня эритроцитов в крови и исследование уровня ретикулоцитов в крови с определением среднего содержания и средней концентрации Hb в эритроцитах, определение размеров эритроцитов у пациентов с анемическим синдромом с целью диагностики ЖДА [9]. Отличительными признаками ЖДА являются низкий уровень сывороточного ферритина, отражающий истощение тканевых запасов железа, и повышенные показатели общей железосвязывающей способности сыворотки (ОЖСС) и трансферрина. Показатели сывороточного железа и коэффициент насыщения трансферрина железом (НТЖ) в типичных случаях снижены, однако наличие нормальных и даже повышенных показателей не исключает диагноз ЖДА, поскольку прием пациентом накануне исследования железосодержащих препаратов, мясная диета или предшествующая (за 10–14 дней) трансфузия эритроцитсодержащего компонента крови донора могут исказить показатель сывороточного железа и, соответственно, коэффициент НТЖ, что необходимо учитывать при оценке результатов исследования. Всем пациентам с подозрением на ЖДА необходимо исследовать сывороточные показатели обмена железа – уровни ферритина в крови, трансферрина сыворотки крови, ОЖСС, уровень железа сыворотки крови и коэффициент НТЖ для верификации наличия абсолютного дефицита железа.
ВОЗ рекомендует диагностировать анемию во время беременности при концентрации Hb<110 г/л [14]. Ключевым, наиболее удобным с точки клинической интерпретации результатов биохимическим параметром для подтверждения дефицита железа является ферритин сыворотки (ФС) крови [15]. ФС целесообразно использовать для верификации ЛДЖ, когда показатели Hb и/или СЖ сохраняются в пределах нормы. Нормальное содержание ФС у здоровых женщин – 32–60 мкг/л. Сниженным у небеременных женщин считаются значения ФС менее 15 мкг/л, однако при ФС менее 30 мкг/л следует говорить об истощении запасов железа в организме и необходимости назначения препаратов железа [16]. Необходимо принимать во внимание снижение ФС в норме к концу беременности, а также невозможность однозначной трактовки значений ФС при наличии признаков воспаления.
Принципы терапии ЛДЖ и ЖДА у женщин репродуктивного возраста и у беременных
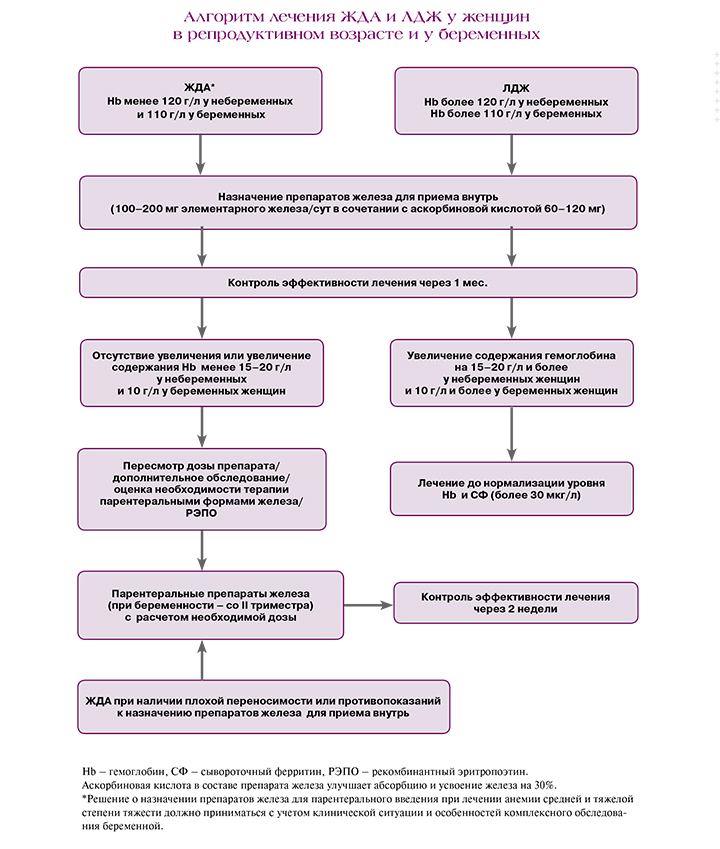
Для эффективного лечения ЖДА и ЛДЖ необходимы, с одной стороны, устранение факторов и лечение заболеваний, приводящих к их формированию, в первую очередь – аномальных маточных кровотечений, с другой – обязательное лечение препаратами железа. Перед назначением препаратов железа необходимо удостовериться о железодефицитном генезе анемии.
При значениях ФС выше 60 мкг/л необходимость в приеме препаратов железа отсутствует. При значениях ФС в пределах 30–60 мкг/л рекомендуются добавки железа в дозе 30–40 мг/сут [16]. При снижении уровня ФС менее 30 мкг/л, соответствующем ЛДЖ, требуется прием 80–100 мг элементарного железа в сутки [17]. Прерывистые курсы препаратов железа во время беременности (2–3 раза в неделю) эффективны так же, как и ежедневные и могут быть связаны с уменьшением частоты побочных эффектов [18].
Лечение ЖДА должно проводиться с учетом степени тяжести заболевания. У небеременных женщин терапия должна происходить при снижении уровня гемоглобина менее 120 г/л, у беременных женщин – менее 110 г/л.
При лечении ЖДА легкой степени без воспаления рекомендованы пероральные препараты, с воспалением – противовоспалительная терапия и внутривенное железо, при средней степени, неэффективности или непереносимости перорального железа рекомендуется внутривенное введение железа в условиях стационара (вторая линия терапии), а при тяжелой – наряду с парентеральным введением железа возможно использование препаратов рекомбинантного человеческого эритропоэтина или гемотрансфузии (переливание эритроцитсодержащих компонентов должно быть предусмотрено у женщин с риском дальнейшего кровотечения, нарушениями сердечной деятельности или при наличии симптомов, требующих немедленного внимания).
Максимальная эффективная и безопасная разовая доза элементарного железа при терапии ЖДА составляет 100 мг, а суточная не должна превышать 300 мг. Формы железа с замедленным высвобождением (Сорбифер Дурулес) предотвращают контакт атомов металла со слизистой оболочкой желудка, поскольку высвобождение его происходит только при смене кислотности среды в просвете двенадцатиперстной кишки, где осуществляется основной объем абсорбции железа. Равномерное высвобождение препарата начинает происходить только в кишечнике, поступление лекарственного препарата в кровь происходит в течение 6 ч [19]. Высокая биодоступность сульфата железа в сочетании с аскорбиновой кислотой для улучшения всасывания обеспечивает более высокий темп прироста гемоглобина по сравнению с другими пероральными железосодержащими препаратами, особенно при тяжелой форме анемии [20].
Назначение внутривенного железа должно рассматриваться при анемии средней степени тяжести или тяжелой, во время беременности – начиная со II триместра беременности при подтвержденном диагнозе ЖДА при непереносимости или отсутствии ответа на терапию пероральными препаратами железа. Назначение внутривенного железа также может быть рассмотрено у женщин после 34 недель беременности с подтвержденным дефицитом железа и концентрацией гемоглобина менее 100 г/л [21].
Эффективное назначение препаратов железа вне беременности должно приводить к увеличению концентрации гемоглобина на 20 г/л через 3–4 недели или на 1–2 г/л/сут [22, 23]. Во время беременности достижение подобных целевых значений труднодостижимо на фоне продолжающегося увеличения расходов железа на формирование дополнительных потребностей фето-плацентарного комплекса и кровообращения, поэтому следует стремиться к увеличению концентрации гемоглобина на 10 г/л через 3–4 недели беременности.
В целом терапия ЖДА должна быть длительной и продолжаться до нормализации показателей не только гемоглобина, но и восполнения запасов железа в депо. После нормализации показателей гемоглобина лечение должно быть продолжено в течение 3 месяцев и по крайней мере до 6 недель послеродового периода для восполнения запасов железа [22, 24]. Перед прекращением терапии необходимо удостовериться в нормализации показателей клинического анализа крови и сывороточного ферритина [25].
Заключение
Учитывая высокую частоту железодефицитных состояний у женщин репродуктивного возраста и в период беременности, своевременная постановка диагноза и рациональная заместительная терапия препаратами железа должны стать неотъемлемой частью комплекса лечебно-диагностических мероприятий, направленных на снижение заболеваемости и улучшение качества жизни женского населения. Принимая во внимание междисциплинарные аспекты проблемы, необходимо совершенствовать знания всех специалистов (акушеры-гинекологи, терапевты, врачи общей практики, гематологи, трансфузиологи), участвующих в консультировании и оказании профильной помощи женскому населению с анемическим синдромом, с одной стороны, и информировать женщин репродуктивного возраста о медицинских аспектах заболевания, возможностях профилактики и терапии заболевания – с другой. Особое внимание необходимо уделять диагностике и коррекции дефицита железа в процессе преконцепционной подготовки и комплексного лечения аномальных маточных кровотечений.