ОПРЕДЕЛЕНИЕ
Женское бесплодие маточного происхождения. В настоящее время не существует согласованного определения маточной формы бесплодия. Обычно его определяют либо как абсолютное (при отсутствии матки), либо как функциональное (при различных заболеваниях, таких как полип, лейомиома, аденомиоз, синехии, пороки развития матки), проявляющееся дефектом имплантации яйцеклетки [1]. Бесплодие, связанное с хроническим эндометритом, также относят к маточной форме.
Эндометриальная дисфункция характеризуется наличием патологических изменений в эндометрии, таких как несоответствие строения эндометрия дню менструального цикла, снижение экспрессии рецепторов эстрогенов и прогестерона, нарушение рецептивности эндометрия, патологический неоангиогенез, что приводит к нарушению имплантации либо инвазии трофобласта, формированию плаценты с дефицитным кровотоком и, как следствие, – осложнениям беременности, что в сочетании с воспалением в хорионе (плаценте) ведет к ее досрочному завершению [2].
Хронический эндометрит (ХЭ) – заболевание, характеризующееся длительным, непрерывным субклиническим/малосимптомным умеренным воспалением эндометрия, которое сопровождается инфильтрацией плазматическими клетками стромы эндометрия, иммунологической реакцией на инфекцию и нарушением репродуктивной функции [3, 4].
Тонкий эндометрий – состояние, характеризующееся толщиной эндометрия (М‑эхо) менее 7 мм по данным УЗИ в пролиферативную фазу менструального цикла и кратным снижением частоты имплантации эмбриона [5]. Также рядом авторов в качестве порогового рассматривается значение М‑эхо 6 мм [6].
Рецидивирующая неудача имплантации (РНИ; англ.: recurrent implantation failure, RIF) – в программах вспомогательных репродуктивных технологий (ВРТ) относится к случаям, когда у женщин было три неудачных попытки экстракорпорального оплодотворения (ЭКО) с эмбрионами хорошего качества [7].
КОДИРОВАНИЕ ПО МЕЖДУНАРОДНОЙ КЛАССИФИКАЦИИ БОЛЕЗНЕЙ
В Международной статистической классификации болезней и проблем, связанных со здоровьем, Х пересмотра:
- N97.2 Женское бесплодие маточного происхождения (дефект имплантации яйцеклетки);
- N97.9 Женское бесплодие неуточненное;
- N71.1 Хроническая воспалительная болезнь матки.
В Международной статистической классификации болезней и проблем, связанных со здоровьем, ХI пересмотра:
- GA31.00 Первичное женское бесплодие маточного происхождения (женское бесплодие, вызванное отсутствием имплантации эмбриона);
- GA31.10 Вторичное женское бесплодие маточного происхождения;
- QA30.10 Обращение в медицинские организации для экстракорпорального оплодотворения;
- GA01.10 Хронический эндометрит.
ЭПИДЕМИОЛОГИЯ
Систематический обзор (188 исследований) показал, что на долю бесплодия маточного происхождения приходится от 2,1 до 16,7% причин женского бесплодия в мире [1]. У пациенток с бесплодием ХЭ обнаруживается с частотой от 2,8 до 56,8%, по данным зарубежных публикаций [8], и от 60,8 до 88,9% – отечественных [9, 10]. РНИ при использовании ВРТ наблюдаются у 7,7–67,5% пациенток с ХЭ [8, 11]. Частота тонкого эндометрия в циклах ЭКО составляет от 1 до 2,5%, в циклах стимуляции яичников может достигать 38–66% [12].
ЭФФЕКТИВНОСТЬ ВСПОМОГАТЕЛЬНЫХ РЕПРОДУКТИВНЫХ ТЕХНОЛОГИЙ У ПАЦИЕНТОК С БЕСПЛОДИЕМ
Эффективность ВРТ в России (Центральный федеральный округ) по показателю наступления клинической беременности, подтвержденной УЗИ, составляет в среднем 31,5% с разбросом от 20,2 до 40,9%, при этом за пороговое значение принят показатель 30% [13].
Эффективность ЭКО у пациенток с ХЭ не превышает 30% за цикл лечения, и в возрасте 37 лет и старше вероятность наступления беременности и живорождения в 2,6 раза ниже в сравнении с пациентками более молодого возраста [14, 15].
ЭТИОЛОГИЯ
Верхние отделы репродуктивной системы у здоровых женщин содержат микробиоту с низкой биомассой, содержащей до 90% Lactobacillus и около 10% других микроорганизмов (включая до 191 таксономических единиц), но ее состав остается невыясненным [16]. Сообщается о присутствии в матке Prevotella, Gardnerella, Atopobium, Sneathia, Bifidobacterium, Megasphaera и Anaerococcus [17, 18]. Обилие Lactobacillus в эндометрии связано с увеличением частоты имплантации, беременности и живорождений [19].
Доказано, что инфекционный фактор является основой воспалительной болезни матки [20]. Наблюдаются увеличение биомассы микроорганизмов, их разнообразие и снижение численности лактобактерий [18]. Спектр микроорганизмов в отделяемом из полости матки у пациенток с ХЭ включает E. coli, Streptococcus spp., Enterococcus spp., Staphylococcus spp., Mycoplasma spp., U. urealyticum, G. vaginalis, Proteus, Klebsiella pneumoniae, Corynebacterium spp., дрожжеподобные грибы (Candida spp. и Saccharomyces spp.), Mycobacterium tuberculosis (последние – в южно‑азиатских странах) [3]. По данным российского исследования, наиболее часто в полости матки выявляются стафилококки (44,8%), Enterobacteriaceae (22,1%), Ureaplasma spр. (19,3%), Streptococcus spp. (15,2%), G. vaginalis (11,0%), A. vaginae (10,3%) при снижении лактобактерий (66,2%) [20]. Наличие уреаплазмы увеличивает риск развития ХЭ в 4,5 раза (ОШ=4,9), персистенция A. vaginae и Staphylococcus spp. – в 7 раз (ОШ=6,9) и 2,5 раза (ОШ=2,5) соответственно. В другом исследовании ДНК G. vaginalis присутствовала в 30% образцов у пациенток с ХЭ [18]. В ряде более ранних публикаций отмечено отсутствие микроорганизмов в эндометрии при исследовании микробиологическим (культуральным) методом, что объясняется наличием некультивируемых микроорганизмов.
Основным предполагаемым источником микроорганизмов в полости матки является влагалище. В его микробиоте у пациенток с ХЭ обнаружены энтерококки, коагулазонегативные стафилококки, уреаплазмы и многокомпонентные ассоциации [21].
Дискордантность между различными локусами репродуктивного тракта составляет 10–30% [10]. Тем не менее обнаружена четкая связь между изменениями вагинального микробиома и развитием ХЭ [21] и показано, что РНИ связаны с увеличением разнообразия микробиома и потерей доминирования Lactobacillus в нижних отделах женской репродуктивной системы [22]. Streptococcus в составе микробиоты влагалища вносит наибольший вклад в снижение частоты имплантации при ВРТ [23].
C. trachomatis и N. gonorrhoeae, патогены, связанные с острым эндометритом, редко встречаются при ХЭ (2–8 и 0–7% соответственно), что позволяет рассматривать острый и хронический эндометрит как два различных патологических состояния [3].
У большинства пациенток с бесплодием наблюдается выделение вирусов – герпеса человека HHV‑6A, простого герпеса (ВПГ) 1 и 2 типов, вируса папилломы человека (ВПЧ) [24–26], и при ХЭ встречается у 86%, с преобладанием ВПГ 1 и 2 типов (80%), цитомегаловируса и ВПЧ (по 50%), Эпштейна–Барр (42%) и их сочетания – у 50% [27]. По данным других авторов, ВПГ 1 и 2 типов выявляется у 65% пациенток, а вирус Эпштейна–Барр – у 56% [28].
Таким образом, ХЭ связан с качественным и количественным изменением микробиоты с персистенцией различных микроорганизмов в эндометрии. Преобладает мнение о превалировании микробных ассоциаций, особенно аэробных и анаэробных условно‑патогенных микроорганизмов (УПМ), когда их вирулентность в составе биопленок и устойчивость к антибиотикам (АБ) возрастают.
Большое разнообразие бактериальных и вирусных агентов в эндометрии не позволяет определить ведущего возбудителя в патогенезе патологического воздействия на эндометрий, имплантацию и развивающийся эмбрион. В этой связи «доказанного или потенциально значимого возбудителя» ХЭ обнаружить у пациенток в рутинной клинической практике не представляется возможным. Это определяет эмпирический подход к выбору АБ с широким спектром действия для терапии данного заболевания, что позволяет преодолеть дискордантность между микробиотой эндометрия и влагалища.
Иное состояние представляет тонкий эндометрий, однако его нередко отождествляют с ХЭ. О персистенции микроорганизмов и наличии воспаления в тонком эндометрии в литературе не сообщается. Причиной его является низкая регенерация в результате разрушения базального слоя и развития фиброза в строме как исход острого или хронического воспаления эндометрия или инструментального повреждения при внутриматочных вмешательствах [6].
ПАТОГЕНЕЗ
ХЭ представляет собой длительно текущее воспаление, возникающее в результате распознавания микроорганизмов TOLL‑подобными рецепторами эндометрия, при этом происходит активация клеток врожденного иммунитета макрофагально‑моноцитарного ряда, продуцирующих провоспалительные цитокины (ЦК), которые обеспечивают ответ, направленный на ликвидацию бактерий и вирусов. Так, у пациенток с ХЭ отмечается значительное повышение содержания цитотоксических Т‑лимфоцитов (CD8), В‑лимфоцитов (CD20) и плазмоцитов (CD138), интерлейкина (ИЛ)‑6, ИЛ‑1β и фактора некроза опухоли (ФНО)‑α, дисбаланс Т‑хелперов 1‑го и 2‑го типов [29–32].
В настоящее время аутоиммунная природа ХЭ не подтверждается. Показано, что пациенты с ХЭ и/ или неудачей имплантации не отличаются по системным воспалительным или аутоиммунным профилям от пациентов без ХЭ [2, 33, 34]. Обнаружено локальное повышение уровней ЦК провоспалительного звена, что свидетельствует об активации иммунитета и воспалительной реакции в ответ на инфекцию с увеличением натуральных киллеров и активацией цитотоксических факторов к клеткам эндометрия. Таким образом, персистенция микроорганизмов и особенности локальной иммунной защиты становятся основой развития каскада вторичных повреждений, в результате чего не завершается воспалительная реакция, не происходит регенерации ткани и возникает выраженный клеточный дисбаланс [31].
Среди механизмов бесплодия, связанного с ХЭ, выделяют рецептивную недостаточность эндометрия вследствие иммунологической реакции на персистирующую инфекцию, уменьшение эндометриального кровотока из‑за неравномерной плотности сосудов, утолщения их просвета и тромбоза, нарушение децидуализации эндометрия в результате снижения действия эстрогенов и прогестерона, а также асинхронных маточных сокращений, приводящих к нарушению контакта эмбриона с децидуальной оболочкой [4].
Исследователи обращают внимание на то, что на начальных этапах ХЭ существует компенсаторный механизм, позволяющий сохранять имплантационную способность эндометрия благодаря реакции иммунной системы матери в отношении УПМ. Однако формирование со временем морфологических изменений в эндометрии приводит к критичному нарушению его рецептивности и, как следствие, к бесплодию. Установлена прямая умеренная корреляционная зависимость между длительностью течения ХЭ (в среднем 5,5 года) и частотой развития бесплодия (у 83% пациенток) [35].
Исследования показали, что клеточное старение в строме и эпителии вместе с избыточным отложением коллагена вокруг кровеносных сосудов связано с истончением эндометрия [36]. Разрушение базального слоя эндометрия, развитие фиброза, резкое нарушение кровообращения в сосудах матки приводят к недостаточному росту эндометриальных желез и снижению ангиогенеза вследствие уменьшения секреции фактора роста эндотелия сосудов. При этом процесс имплантации эмбриона затруднен из‑за отсутствия адекватного эндометриального ложа [6]. Кроме того, в тонком эндометрии выявлены аберрантная межклеточная сигнальная связь и дисфункция метаболических путей со снижением регуляции углеводного обмена и метаболизма нуклеотидов, а также переключением энергетического обмена [37].
КЛИНИЧЕСКАЯ КАРТИНА
ХЭ имеет нечеткую клиническую картину, а его симптомы – неспецифический характер [38]. Клинические проявления ХЭ включают:
- аномальные маточные кровотечения (дисменорея, ациклические, межменструальные или перименструальные кровянистые выделения);
- тянущие боли или дискомфорт внизу живота;
- патологические выделения из половых путей.
У большинства пациенток заболевание протекает бессимптомно. Подозрение на его наличие появляется при бесплодии, включая неудачи ЭКО и привычное невынашивание беременности.
ДИАГНОСТИКА
Диагностика бесплодия, обусловленного хроническим эндометритом
Диагностика бесплодия осуществляется на основании Клинических рекомендаций «Женское бесплодие» [38], диагностический поиск ХЭ – в соответствии с «Алгоритмом диагностики и лечения хронического эндометрита» [39] и включает следующие методы оценки эндометрия: УЗИ органов малого таза в пролиферативную фазу (толщина М‑эхо и его структура) (уровень убедительности рекомендаций, уровень достоверности доказательств – С, 4); гистероскопическое исследование для исключения другой внутриматочной патологии (синехий, полипа, субмукозной миомы матки) (А, 1b); морфологическое исследование аспирата эндометрия («золотой стандарт»), полученного с помощью пайпель‑биопсии, на 19–22‑й день при 28‑дневном менструальном цикле или на 23–26‑й день – при 35‑дневном (В, 2а); иммуногистохимическое исследование (ИГХ, «первая линия диагностики») с определением CD138 (плазматические клетки) при окраске синдиканом 1. Также рекомендуется определять CD20 (В‑лимфоциты), CD4 (Т‑хелперы) и CD8 (цитотоксические Т‑лимфоциты), что позволяет увеличить диагностическую ценность исследования и устранить разноречивость трактовки (В, 2а); молекулярно-генетическое исследование отделяемого из влагалища методом ПЦР в реальном времени на абсолютные патогены, УПМ и вирусы (забор материала из полости матки в рутинной практике не рекомендуется) (В, 2а).
Существует необходимость достичь консенсуса по критериям ХЭ, чтобы исключить гипердиагностику [40] и влияние гетерогенности исследований на результаты [41]. Предлагается проводить диагностику ХЭ по стандартизованным морфологическим критериям [29, 42] и наличию хотя бы одной плазматической клетки в 10 случайных полях зрения в строме эндометрия при увеличении ×400 по данным ИГХ [43].
Методы оценки иммунного статуса
Иммуноферментное исследование – определение баланса прои противовоспалительных ЦК. Значительное повышение концентрации ИЛ‑1β, ‑6 и ‑8 вызывает подавление нормальной микробиоты в полости матки и рост УПМ, что ведет к прогрессированию ХЭ. Избыточная продукция ФНО‑α вызывает расстройства гемодинамики, оказывает цитотоксическое действие на клетки эндометрия. Индукция ИЛ‑4 и ИЛ‑10 сдерживает избыточную продукцию провоспалительных ЦК, предупреждая повреждение ДНК, белков и липидов неинфицированных клеток и тканей эндометрия. Важность данного исследования определяется использованием показателей цитокинового статуса для прогнозирования наступления беременности и живорождения (В, 2а) [44–46].
Методы оценки функционального состояния эндометрия
Лазерное конверсионное тестирование (ЛКТ) позволяет объективно выявлять и клинически оценивать состояние эндометрия и его готовность к имплантации у пациенток с ХЭ [47]. Исследование выполняется с помощью медицинского спектрометра «Фотон‑Био» (ООО «Фотон‑Био», Россия) и занимает 2–3 минуты. Физической основой метода является спектральный анализ, который регистрирует спектральные характеристики отраженного излучения и выдает результаты в виде цифровых значений.
Состояние эндометрия описывается с помощью четырех параметров.
- Индекс оксигенации (ИО) позволяет оценить насыщение эндометрия кислородом (нормальное значение – более 80%) и является наиболее важным параметром, характеризующим фертильность. Наступление беременности возможно при снижении ИО на 15–20%, но нередко заканчивается гибелью эмбриона.
- Индекс пролиферативной активности (ИПА) отражает морфологию эндометрия и прямую зависимость от фертильности (нормальное значение – от 0,47 до 0,63 у.е. на 8–12‑й день, от 0,64 до 0,70 на 13–14‑й день, от 0,95 до 1,11 на 22–26‑й день менструального цикла). Сдвиг ИПА (смещение окна имплантации) на 7 дней и более, как правило, не приводит к беременности, на 3–5 дней – приводит к неразвивающейся беременности.
- Индекс структурированности (ИС) характеризует отличия спектров в трех точках внутри матки, при возрастании отличий этот показатель снижается (нормальное значение – более 2), что может привести к аномальному (низкому) прикреплению эмбриона, в дальнейшем – к низкой плацентации.
- Индекс патологии (ИП) показывает отклонения при воспалительных или гиперпластических изменениях в эндометрии (в норме – значение ниже 1,5 у.е.).
Чувствительность метода ЛКТ (по отношению к исследуемому комплексу морфо‑метаболических показателей) составляет 99%, специфичность – 89% [47] (В, 2а).
ПРОГНОЗИРОВАНИЕ НАСТУПЛЕНИЯ БЕРЕМЕННОСТИ И ЖИВОРОЖДЕНИЯ
Процесс диагностики причин бесплодия, лечения и ЭКО имеет высокие временные издержки, влияет на эмоциональное состояние супружеской пары и является финансово обременительным. Вероятно, избежать этих потерь можно, имея информацию о предполагаемом успехе ЭКО перед его выполнением.
Методы определения рецептивности эндометрия
Для определения маркеров рецептивности эндометрия (РЭ) активно изучаются такие методы, как электронно‑микроскопические, иммунологические, молекулярно‑генетические и многие другие. Однако все они, скорее, дают представления о фундаментальных аспектах процесса имплантации, но не пригодны для клинической практики [48]. Полученные данные не подтверждают рутинное использование тестирования на РЭ (смещение «окна имплантации») для определения времени переноса эмбрионов при ЭКО, поскольку это не приводит к увеличению частоты живорождений. То есть проблема заключается не в корректировке времени переноса эмбриона, а в выявлении патологии эндометрия, которая требует лечения.
Модель прогноза ЭКО с помощью лазерного конверсионного тестирования
С целью определения предикторов успеха в достижении беременности и живорождения у женщин с ХЭ после комплексного лечения в период прегравидарной подготовки на этапе отбора в программы ЭКО с криопереносом может быть использована технология ЛКТ [49].
Важным является выбор показателей, свидетельствующих о разрешении ХЭ, – отсутствие лимфоидных инфильтратов при гистологическом исследовании эндометрия и отсутствие CD138 – при ИГХ. Показано, что они коррелируют со значениями ЛКТ, при этом ИО и ИПА оказались значимыми для прогноза наступления беременности и живорождений; ИС имел прогностическое значение только для живорождения (табл. 1).
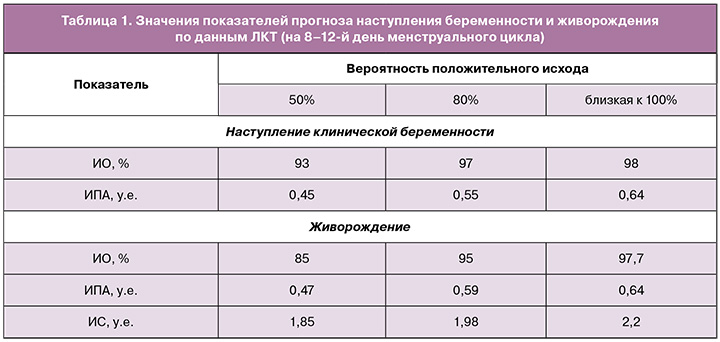
Выбор указанных предикторов подтвержден графиками ROC‑кривых с AUC от 0,67 до 0,75, чувствительностью 80% и точностью прогноза 75% [49].
Информация о готовности эндометрия к имплантации яйцеклетки перед выполнением ЭКО позволяет принять решение о проведении данной процедуры с высоким показателем успеха либо о необходимости проведения повторного (‑ых) курса (‑ов) лечения для достижения полного разрешения ХЭ.
Модель прогноза наступления спонтанной беременности с помощью нейросетевой технологии
Модель прогноза спонтанного наступления беременности была разработана на основе нейросетевого анализа, в результате которого были выделены 8 наиболее значимых параметров. Точность прогноза составляет 88,0% (чувствительность – 94,2%, специфичность – 82,4%). Информативность нейросетевого анализа данных подтверждена ROC‑анализом: AUC=0,88; p<0,001 [45]. Для целей практического применения модели разработан онлайн‑калькулятор (https://pentcroft.ru/informaciya/kalkulyatory/).
Для работы с калькулятором и получения надежного прогноза необходимо провести обследование пациентки и определить следующие показатели: продолжительность бесплодия (лет), уровень образования (среднее/среднее специальное/высшее), применялся ли комплекс антимикробных пептидов и цитокинов «Суперлимф» (да/нет), ИО (%), пульсационный индекс в радиальных артериях по данным допплерометрии (абс.), CD138 в эндометрии (абс. количество в 10 полях зрения при увеличении ×400), ИЛ‑4 (пг/мл), ИЛ‑1β (пг/мл). Все параметры имеют патогенетическое значение и важны для прогноза. Их необходимо внести в окна калькулятора и нажать кнопку «Оценить». Результат интерпретируют следующим образом: «Вероятность наступления беременности высокая» (зеленый маркер) – положительный прогноз; «Вероятность наступления беременности низкая» (красный) – отрицательный прогноз.
Калькулятор позволяет либо определить необходимость в проведении повторного(‑ых) курса(‑ов) лечения ХЭ (при отрицательном прогнозе), либо принять решение о планировании беременности (при положительном).
Модель прогноза наступления беременности и живорождения в программах ЭКО с помощью нейросетевой технологии
Модель прогноза ЭКО создана на основе нейросетевой технологии, в результате применения которой были выделены 12 значимых параметров [46]. Информативность модели подтверждена ROC‑анализом: AUC=0,90; p<0,001. Точность прогноза 97,9% (чувствительность – 100%, специфичность – 96,4%). Для целей практического применения модели индивидуального прогноза успешности ЭКО разработан онлайн‑калькулятор (https://pentcroft.ru/informaciya/kalkulyatory/).
Для работы с калькулятором и получения надежного прогноза необходимо провести обследование пациентки и оценить следующие показатели: занятость (работает/домохозяйка), роды в анамнезе (абс.), применялся ли комплекс антимикробных пептидов и цитокинов «Суперлимф» (да/нет), ИО (%), ИС (у.е.), ИПА (у.е.), пульсационный индекс в радиальных артериях по данным допплерометрии (абс.), CD138 в эндометрии (абс. количество в 10 полях зрения при увеличении ×400), ИЛ‑4 (пг/мл), ИЛ‑10 (пг/мл), ФНО‑ɑ (пг/мл), ИЛ‑1β (пг/мл). Все параметры имеют патогенетическое значение и важны для прогноза. Их необходимо внести в окна калькулятора и нажать кнопку «Оценить». Интерпретация результата: «Вероятность наступления беременности высокая» (зеленый маркер) – положительный прогноз; «Вероятность благоприятного исхода ЭКО – низкая» (темно‑серый) – прогноз сомнительный (высокая вероятность выкидыша в ранние сроки); «Вероятность наступления беременности низкая» (красный) – отрицательный прогноз.
Результат позволяет либо определить необходимость в проведении повторного(‑ых) курса(‑ов) лечения ХЭ (при отрицательном или сомнительном прогнозе), либо принять решение о проведении ЭКО (при положительном).
Бактериальный вагиноз как фактор риска хронического эндометрита. Прогноз рецидивов бактериального вагиноза
В систематическом обзоре и метаанализе показано, что бактериальный вагиноз (БВ) в 3,3 раза чаще выявляется у бесплодных женщин, чем у фертильных в той же популяции, достигая 39% [50]. Показано, что БВ связан с доклинической потерей беременности (ОР=2,36; 95% ДИ 1,24–4,51) [51] и самопроизвольными выкидышами (ОР=1,68; 95% ДИ 1,24–2,27) [50]. Предполагается связь между БВ и ХЭ на основании выявленного повышения риска ХЭ у пациенток с симптоматическим БВ (ОШ=15,0; 95% ДИ 2–686) и наличия микроорганизмов, ассоциированных с БВ (ОШ=12,4; 95% ДИ 2–132) [52].
Поэтому важным компонентом для улучшения результатов естественной и вспомогательной репродукции при симптоматическом БВ является его лечение до зачатия. Учитывая высокую частоту рецидивов БВ – до 80% в течение 6 месяцев, становится актуальным вопрос о разработке прогностических тестов, которые могли бы предсказать рецидив и повлиять на индивидуальный выбор лечения. Большинство исследований на эту тему либо противоречивы, либо недостаточно доказательны.
Разработан метод прогноза рецидивов БВ по показателю концентрации цитокина ИЛ‑4 после лечения [53]. Присутствие ИЛ‑4 в тканях способствует ингибированию провоспалительных ЦК, альтернативной активации макрофагов и увеличению количества репаративных макрофагов, что сопровождается секрецией ИЛ‑10 и трансформирующего фактора роста (ТФР)‑β, что приводит к уменьшению патологического воспаления.
При концентрации ИЛ‑4 во влагалищном содержимом от 60 до 79 пг/мл вероятность рецидива БВ колеблется от 50 до 80% в течение 6 месяцев после лечения; если его концентрация 95 пг/мл и более – вероятность развития рецидива БВ 80% и выше в течение 6 месяцев после лечения (чувствительность – 78%, специфичность – 74%). Точка разделения (вероятность развития рецидива, равная 50%) определена на уровне 60 пг/мл, что выше среднего показателя условно здоровых женщин в 2 раза (28 пг/мл) и превышает верхнюю границу диапазона референсных значений лаборатории (52 пг/мл).
Наличие высоких значений ИЛ‑4 у пациенток с БВ и сохранение таковых после проведенного лечения свидетельствует о недостаточном иммунном ответе на инфекционные агенты и незавершенности процесса элиминации возбудителей, что и создает предпосылки для развития рецидивов. Положительный прогноз рецидива БВ позволяет определить необходимость комплексного подхода с использованием адъювантных методов лечения (иммуномодулирующая терапия комплексом антимикробных пептидов и цитокинов) [54].
МЕТОДЫ ВОССТАНОВЛЕНИЯ ФЕРТИЛЬНОСТИ У ПАЦИЕНТОК С ДИСФУНКЦИЕЙ ЭНДОМЕТРИЯ, ОБУСЛОВЛЕННОЙ ХРОНИЧЕСКИМ ЭНДОМЕТРИТОМ
Медикаментозное лечение
Антибактериальная терапия
Обоснование. Целесообразность применения АБ в терапии ХЭ не вызывает сомнений, что обусловлено общепризнанным фактом персистенции микробной инфекции в эндометрии.
Рекомендуемые схемы. Первой линией АБ-терапии считают доксициклин 100 мг 2 раза в день в течение 14 дней (А, 1). Вторая линия включает ципрофлоксацин 500 мг 2 раза в день в течение 10 дней и метронидазол 500 мг 1 раз в сутки в течение 2 недель или офлоксацин 400 мг 1 раз в сутки и метронидазол 500 мг 1 раз в сутки в течение 2 недель, в резистентных случаях – миноциклин 200 мг в сутки 12 дней (А, 1) [3].
Описаны также конкретные схемы в соответствии с микробиологическим профилем пациенток: при положительном результате на грамотрицательные бактерии – ципрофлоксацин 500 мг 2 раза в день в течение 10 дней в качестве терапии первой линии; при грамположительных бактериях – амоксициллин/клавуланат 1 г 2 раза в день в течение 8 дней; при инфекциях, вызванных микоплазмами и U. urealyticum, – джозамицин 1 г 2 раза в день в течение 12 дней, в случае персистенции – миноциклин 100 мг 2 раза в день в течение 12 дней; при отрицательных посевах – цефтриаксон 250 мг внутримышечно однократно плюс доксициклин 100 мг перорально 2 раза в день с метронидазолом 500 мг перорально 2 раза в день в течение 14 дней (В, 2) [3]. В случае сохранения признаков ХЭ и персистенции инфекции протокол можно повторить до трех раз (С, 3) [55].
В последнее десятилетие наблюдается рост частоты ХЭ с множественной лекарственной устойчивостью у женщин с анамнезом РНИ (7,8% всех случаев ХЭ), а также показана эффективность азитромицина (250 мг 2 раза в день в течение 3 дней) или моксифлоксацина (400 мг 1 раз в день в течение 10 дней) в разрешении ХЭ и улучшении результатов при последующих циклах ЭКО (С, 4) [56].
Эффективность. Разрешение ХЭ после АБ-терапии наблюдается у 82,3% пациенток, и среди них существенно выше частота наступления беременности (76,3% против 20% без лечения) и живорождений (65,8% против 6,6% соответственно) [57]. Показано, что разрешение ХЭ после одного курса АБ наблюдалось у 32,3% пациенток, суммарно после двух курсов – у 64,6%, после трех – у 81,3% против 6% без лечения [55]. РЭ имеет тенденцию к улучшению после АБ-терапии – частота живорождения после ЭКО была значительно выше у пациенток, отвечающих на АБ-лечение (60,8%), чем у пациенток с персистирующим ХЭ (13,3%) [58]. У женщин с излеченным ХЭ частота клинической беременности была сопоставима с женщинами без ХЭ (56,1% против 60,0%; скорректированный ОШ=0,83; 95% ДИ 0,66–1,03, p>0,05) [59].
Метаанализ 12 РКИ, выполненный в 2022 г., убедительно показал, что сам факт применения АБ у женщин с ХЭ и РНИ не оказывает влияния на исходы, тогда как у пациенток с излеченным ХЭ показатели частоты наступления клинической беременности и коэффициента рождаемости были выше (ОШ=1,56 и 1,57 соответственно) по сравнению с женщинами без ХЭ, кроме того, аналогичные показатели были существенно выше по сравнению с пациентками с персистирующим ХЭ (ОШ=9,75 и 6,82 соответственно) [60]. Метаанализ 14 РКИ 2023 г. подтвердил, что у женщин с разрешением ХЭ после АБ-терапии показатели наступления беременности и живорождения выше в 3 раза [61].
Однако согласно результатам, полученным в исследовании, где сравнивали пациенток с РНИ и ХЭ, прошедших лечение АБ, и пациенток с РНИ без ХЭ, частота наступления беременности (36,4 и 37,9% соответственно) и живорождений (27,9 и 30,1% соответственно) была сопоставима. Это свидетельствует о том, что репродуктивные результаты не могут быть улучшены только применением АБ у пациенток с РНИ [62] и, вероятно, связаны с другими аномалиями эндометрия, которые не были диагностированы [63].
Вариации диагностических критериев ХЭ оказывают влияние на результаты оценки репродуктивных исходов, что показано в метаанализе, – при более строгих критериях отбора частота живорождения после АБ-терапии была выше в 2 раза, свидетельствуя о том, что излеченный ХЭ обеспечивает высококачественные материнские условия для последующего переноса эмбрионов и успешной беременности [41].
АБ-терапия не показана пациенткам с тонким эндометрием, когда признаки воспаления отсутствуют. Это состояние требует проведения реабилитации с целью восстановления морфофункционального потенциала эндометрия, гемодинамики и активности рецепторного аппарата.
Противовирусная терапия
Пациенткам с рецидивирующей симптоматической вирусной инфекцией, вызванной ВПГ‑1 и ‑2, показана супрессивная терапия ациклическими нуклеозидами (ацикловир и др.) в соответствии с Клиническими рекомендациями «Аногенитальная герпетическая инфекция» [64] и инструкциями по медицинскому применению препаратов (В, 1). При рецидивирующем течении заболевания рекомендуется назначение интерферонов (С, 5). При обнаружении бессимптомного вирусовыделения (ВПГ 1 и 2, ВГЧ 6 типа, Эпштейна–Барр, ВПЧ) показана иммуномодулирующая терапия (С, 5).
Иммуномодулирующая терапия
Обоснование. Дисбаланс в иммунной системе и неспособность достичь иммунной толерантности к плоду считаются потенциально модифицируемыми причинами бесплодия и РНИ. Авторы метаанализа, выполненного в 2022 г., сделали вывод о том, что для некоторых подгрупп пациентов использование иммуномодулирующей терапии может оказаться полезным [65]. В сетевом метаанализе наилучшая эффективность была достигнута при внутриматочном введении аутологичных мононуклеарных клеток периферической крови (МКПК) в отношении живорождения (OШ=2,35) и аутологичной богатой тромбоцитами плазмы – в отношении имплантации (ОШ=2,81) по сравнению с другими препаратами [66]. Другой метаанализ показал аналогичные результаты для препаратов МКПК (ОР=2,96) по сравнению с плацебо в повышении живорождения [67].
Публикаций, посвященных изучению эффективности применения интерферонов в лечении ХЭ бактериально‑вирусной этиологии, а также при бесплодии и РНИ, не найдено.
Из доступных в РФ иммуномодуляторов средством с доказанной эффективностью является комплекс антимикробных пептидов и цитокинов (Суперлимф), который представляет собой секрет МКПК (секретóм), полученный из лейкоцитов крови свиней.
Рекомендуемая схема терапии пациенток с бесплодием, обусловленным ХЭ, на прегравидарном этапе включает Суперлимф 25 ЕД вагинально в течение 20 дней в комплексе с АБ (один курс) и гестагеном в циклическом режиме с последующим повторным курсом приема Суперлимфа по той же схеме через 1–1,5 месяца (прием гестагена продолжают до наступления беременности, но не более 6 месяцев) (В, 1а).
Эффективность. Исследования показали, что применение Суперлимфа одновременно с АБ приводит к элиминации инфектов из полости матки в 84% наблюдений против 59,1% при лечении только АБ [68], прекращению вирусовыделения у 66,7% пациенток [69]. Применение Суперлимфа на прегравидарном этапе в составе комплексной терапии (см. выше) способствует разрешению ХЭ у 86% пациенток, спонтанному наступлению беременности в течение 12 месяцев у 83,8% против 45,1% у получавших только АБ, с увеличением шанса практически в 2 раза (ОР=1,86; 95% ДИ 1,69–2,05) [69]. Показатели живорождения составили 73,5 и 33,6% соответственно (ОР=2,19; 95% ДИ 1,93–2,49). Высокая эффективность комплексной терапии отмечена у пациенток с бесплодием 5 лет и более – 89,2% против 16,4% соответственно, с увеличением вероятности наступления спонтанной беременности в 5,4 раза по сравнению с теми, кто получал только АБ (ОР=5,43; 95% ДИ 3,69–8,01), показатель живорождения – 76,5% против 11,9% соответственно (ОР=6,40; 95% ДИ 3,99–10,27) [69].
Комплексная терапия с использованием Суперлимфа на прегравидарном этапе способствует наступлению беременности в программах ВРТ с криопереносом у 57,0% против 38,7% (ОР=1,47; 95% ДИ 1,24–1,75), живорождению – у 45,3% против 20,7% соответственно (ОР=2,19; 95% ДИ 1,70–2,83), а также снижению риска выкидыша в ранние сроки, преждевременных родов и рождения маловесных детей в 2 раза по сравнению с терапией без него, преэклампсии – в 2 раза, гипоксии и задержки роста плода – в 3 раза, антенатальной гибели плода – в 6,7 раза соответственно [70]. Два курса лечения Суперлимфом дают лучшие результаты по сравнению с одним, способствуя увеличению шансов на наступление беременности и живорождения [70].
Гормональная терапия
Обоснование. Непосредственное токсическое влияние цитокинов и фиброз в эндометрии при ХЭ вызывают аберрантную экспрессию рецепторов эстрогенов и прогестерона, что сопровождается индуцированной резистентностью к прогестерону и, как следствие, нарушением дифференцировки клеток и секреторной трансформации эндометрия. Прогестерон, в частности, используемый в протоколах ЭКО, может играть значительную роль в улучшении показателей наступления беременности и живорождения среди пациенток с РНИ, если начинать лечение в лютеиновой фазе [71].
Показания для применения прогестерона на прегравидарном этапе:
- ХЭ с избыточной пролиферацией эндометрия (гиперпластический вариант);
- эндогенная недостаточность прогестерона, доказанная лабораторно.
Роль прогестерона при подготовке эндометрия к имплантации эмбриона определяется также модуляцией иммунной системы [71].
Рекомендуемые схемы. Дидрогестерон 10 мг с 14‑го по 25‑й дни менструального цикла (на протяжении 3–6 циклов в прегравидарном периоде) (В, 2). Применение препаратов микронизированного прогестерона или комбинированных оральных контрацептивов у пациенток с ХЭ в исследованиях не описано, и их эффективность для увеличения толщины и зрелости эндометрия не известна.
Эффективность. В одном из исследований показатели излечения ХЭ в группе комбинированного применения дидрогестерона и АБ и в группе применения только АБ составили 85,2 и 74,3% (разница 10,9%, p<0,05) соответственно [7]. Добавление прогестерона к комплексной терапии, включавшей Суперлимф и АБ, способствовало увеличению частоты наступления беременности и живорождений в среднем на 20%, а также снижению осложнений беременности: самопроизвольных выкидышей в ранние сроки – в 6 раз, преждевременных родов – в 2,5 раза, преэклампсии, гипоксии и задержки роста плода – в 2 раза по сравнению с лечением только АБ [72]. При этом статистически значимой разницы между группами, получавшими гестаген/АБ и только АБ, не было. Значительное улучшение исходов при комплексной терапии объясняется тем, что под влиянием препарата «Суперлимф» происходит увеличение экспрессии рецепторов к прогестерону в эпителии и строме эндометрия в 3 и 2,7 раза соответственно, улучшаются показатели ангиогенеза и васкуляризации ткани эндометрия [28, 73].
Средства для подавления фиброзообразования
Обоснование. Пациенткам с ХЭ и фиброзными изменениями эндометрия, в том числе внутриматочными синехиями, аденомиозом, воспалительными заболеваниями органов малого таза (ВЗОМТ), рекомендовано применение бовгиалуронидазы азоксимера. Фиброз – универсальный процесс, связанный с накоплением протеинов внеклеточного матрикса и уплотнением соединительной ткани с формированием рубцовых изменений [32]. Дефиброзирующий эффект препарата обусловлен деполимеризацией коллагеновых волокон [32, 74]. Исследование in vitro показало, что препарат разрушает биопленки, облегчая проникновение АБ и, таким образом, повышая их эффективность [75].
Рекомендуемые схемы: суппозитории 3000 МЕ вагинально или ректально через день или через 2–3 дня, от 10 до 20 введений, одновременно с АБ‑терапией, или 3000 МЕ внутримышечно 1 раз в 3–5 дней №10–20, при необходимости – повторный курс.
Эффективность. Применение препарата в комплексной терапии у пациенток с ВЗОМТ или аденомиозом привело к разрешению ХЭ (у 50% пациенток) и увеличению толщины эндометрия (до 11,1 мм, р<0,05), частота наступления беременности составила 57% [76]. У пациенток с более сложной патологией – трубно‑перитонеальным бесплодием в сочетании с ХЭ (у 18%), внутриматочными синехиями(у 23%), эндометриозом (у 15%) – проведено комплексное лечение (в том числе у 38% выполнена реконструктивно‑пластическая операция лапароскопическим доступом), включающее 2 курса бовгиалуронидазы азоксимера. Нормализация эндометрия отмечена у 62% пациенток, наступление спонтанной беременности – у 28% [77]. Применение бовгиалуронидазы азоксимера в комплексе с АБ при лечении ХЭ у женщин с РНИ по сравнению с лечением АБ привело к наступлению беременности в первом цикле криопереноса у 78% пациенток против 41,1% (р<0,001), живорождения – у 62,0% против 32,3% (р=0,008) [78].
Немедикаментозное лечение
Пробиотики. Прием пробиотиков, содержащих лактобактерии, внутрь в течение 30 дней (как до, так и во время беременности) не только способствует увеличению числа лактобактерий во влагалище и стабилизации их количества на уровне 60–80%, но и улучшает барьерную функцию клеток эндометрия, способствует снижению концентрации провоспалительных ЦК, что может иметь значение в плане как улучшения фертильности, так и профилактики самопроизвольных выкидышей и преждевременных родов [79].
Аргинин. Результаты систематического анализа исследований указывают на практическую пользу применения аргинина для противоинфекционного иммунитета и лечения бесплодия [80]. Прием добавок L‑аргинина (2 г в комплексе с витаминами) в программах ВРТ приводил к лучшим результатам по сравнению с контролем – через 3 месяца пролонгирование беременности наблюдалось у 47,9% пациенток против 39,5% соответственно [80].
Витамины. По данным 2022 г., глобальная распространенность дефицита по крайней мере одного из трех микроэлементов составляет 69% среди женщин репродуктивного возраста [81]. В Клинических рекомендациях «Воспалительные болезни женских тазовых органов» (2021) указано на необходимость дополнять терапию витаминами [82]. В исследовании, где пациентки принимали витаминно‑минеральный комплекс, наблюдался более высокий процент женщин по крайней мере с одним эмбрионом хорошего качества (58,0%) по сравнению с контрольной группой (36,0%; ОР=1,6, p=0,05) [83].
Средства других групп. Омега‑3 приводит к снижению хемотаксиса моноцитов и нейтрофилов и снижению продукции провоспалительных ЦК [84]. У женщин, принимавших добавки омега‑3 в пренатальный период, вероятность зачатия в естественных циклах была в 1,5 раза выше по сравнению с не принимавшими [85], в циклах ЭКО – в 1,4 раза [86].
Хирургическое лечение
Хирургическое лечение неприменимо к пациенткам с моновариантным ХЭ. Но, говоря о ХЭ, нельзя забывать, что это заболевание может быть вторичным и/или сочетаться с другой патологией матки, которая, в свою очередь, может быть причиной снижения фертильности. В связи с этим хирургическое вмешательство пациенткам с ХЭ и бесплодием показано при следующих выявленных заболеваниях.
Полип эндометрия, субмукозная миома матки. ХЭ у женщин с полипами и миомами обнаружен у 86 и 69% соответственно. Показано увеличение риска ХЭ при наличии полипов эндометрия (ОШ=27,7; 95% ДИ 15,0–51,1), но не миомы (ОШ=2,8; 95% ДИ 0,92–8,17). Частота ХЭ у женщин с субмукозной миомой выше, чем с интрамуральной и субсерозной локализацией узлов (64% против 37% соответственно, p=0,04). Хирургическое их удаление (гистерорезектоскопия) ведет к излечению 90 и 100% пациенток соответственно без АБ‑терапии [87].
Внутриматочные синехии, внутриматочная перегородка. ХЭ у женщин с синехиями и перегородкой в матке обнаружен у 79 и 46% соответственно. Показаны увеличение риска ХЭ при наличии внутриматочных синехий (ОШ=8,9; 95% ДИ 3,3–24,1) и более низкий риск при наличии перегородки (ОШ=0,19; 95% ДИ 0,05–0,66). Разрешение ХЭ, достигнутое с помощью хирургического вмешательства у женщин с синехиями и маточной перегородкой, составляет 93 и 83% соответственно без применения АБ [87].
Истмоцеле. Дефект рубца после кесарева сечения (истмоцеле) является независимым фактором риска ХЭ (ОШ=1,6; 95% ДИ 1,0–2,4) [88]. Частота ХЭ у пациенток с несостоятельным рубцом на матке достигает 52% [89]. Женщинам, планирующим беременность, рекомендуется ушивание истмоцеле на прегравидарном этапе.
Методы восстановления рецептивности тонкого эндометрия
Применяются внутриматочное введение плазмы, обогащенной тромбоцитами, гормональная терапия эстрогенами, коррекция локальной гемодинамики (силденафил цитрат, сулодексид), физиотерапевтическое лечение (электроимпульсная терапия, внутриматочное орошение кавитированными растворами, пелоидотерапия). Однако подробное описание восстановления рецептивности тонкого эндометрия выходит за рамки настоящего алгоритма и представлено в соответствующих публикациях.



